(单词翻译:单击)
第Ⅰ卷(选择题 共36分)
一、选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意)
1. 佛山是远近闻名的陶瓷之都。在陶瓷器制造过程中,一定发生了化学变化的是



A.混合 B.成型C.干燥 D.烧结
2. 今年1月,广西柳州龙江河发生镉污染。但镉是人类的朋友,如制造“镍-镉”充电电池。镉(Cd)的原子序数为48,相对原子质量是112。下列有关说法正确的是
A.镉元素为非金属元素B.镉原子的质量为112g
C.镉原子核外电子数为48 D.镉原子的中子数为48
3.2月29日,新发布的《环境空气质量标准》中增加了PM2.5监测指标。PM2.5是指大气中直径小于或等于2.5微米的颗粒物,对人体健康影响更大,主要来源之一是化石燃料的燃烧。下列措施能减少PM2.5污染的是
A.鼓励开私家车出行 B.鼓励使用太阳能热水器
C.鼓励用煤火力发电 D.鼓励用液化石油气作燃料
4.3月23至25日,佛山展开了“功勋航天员走进校园”活动,学生知道了很多飞船的知识。飞船常利用反应2Na2O2+2CO=2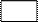 +O2来提供氧气,“
+O2来提供氧气,“ ”中物质的化学式是
”中物质的化学式是
A.CO B.Na2O
C.NaOH D.Na2CO3
5.2012年伦敦奥运会将于7月27日拉开序幕。绿色环保已成为当今奥运会的共同理念,如伦敦奥运会志愿者穿着的马球衫就是100﹪再生涤纶制造。再生涤纶属于
A.无机化工材料 B.合金材料
C.天然纤维 D.合成纤维
6.茶叶中含有丰富的无机矿物元素,包括铁、氟、碘、硒等微量元素,对人体健康有益。上述四种元素中,缺少时易产生龋齿的元素是
A.铁 B.氟
C.碘 D.硒
7.硬水中含有较多的可溶性钙和镁的化合物,会给生活和生产带来许多影响.下列软化硬水程度最高的方法是
A.蒸馏 B.煮沸
C.沉淀 D.过滤
8.氧化物与X的关系可用右下图表示,则X是
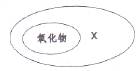
A.混合物
B.金属氧化物
C.化合物
D.单质
9.在配制一定溶质质量分数的氯化钠溶液的实验中,下列实验操作不正确的是
A.氯化钠的取用 B.氯化钠的称量C.水的取用D.氯化钠的溶解
10.连二亚硫酸钠(Na2S2O4),也称保险粉,广泛用于纺织工业,属于一级遇湿易燃物品。下列有关连二亚硫酸钠的认识正确的是
A.连二亚硫酸钠是一种盐,硫元素化合价为+6价
B.连二亚硫酸钠与水能剧烈反应,化学性质很活泼
C.连二亚硫酸钠称为“保险粉”,化学性质很稳定
D.连二亚硫酸钠是一种毫无用处的有害物质
11.黄金是Au对应的单质,化学性质很稳定。而假黄金是铜锌合金,颜色和外形似黄金。下列不能区分黄金与假黄金的方案是
A.在空气中灼烧 B.放在盐酸中
C.放在NaOH溶液中 D.放在AgNO3溶液中
12.豆腐不可与菠菜一起煮,原因是菠菜中含有丰富的草酸、草酸钠,豆腐中含有较多的硫酸钙等钙盐,相互反应生成草酸钙沉淀等物质。其中发生的反应属于
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
13.逻辑推理是一种重要的化学思维方法,以下推理合理的是
A.因为H2O和H2O2的组成元素相同,所以它们的化学性质相同
B.因为蜡烛燃烧生成CO2和H2O,所以蜡烛组成里一定含有C和H
C.因为燃烧需要同时满足三个条件,所以灭火也要同时控制这三个条件
D.因为碱溶液呈碱性,所以呈碱性的溶液一定都是碱溶液
14.在Na2CO3溶液中逐渐加入盐酸,反应后溶液pH随加入盐酸质量变化的关系为
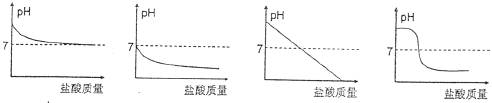
A  B C D
B C D
15.铁在潮湿的空气里会发生锈蚀,证明氧气一定参加了反应必须要做的实验是
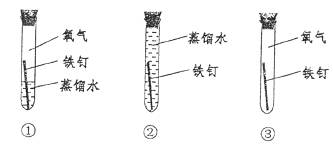
A.①② B.①③
C.②③ D.①②③
二、选择题(本题包括3小题,每小题2分,共6分,每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给2分,但只要错选一个,该题就为0分)
16.在水溶液中能大量共存,且溶液为无色透明的一组物质是
A.CaCl2、Na2CO3、KNO3 B.NaNO3、FeCl3、HCl
C.NaCl、Ba(NO3)2、NaOH D.(NH4)2SO4、NaOH、Na2CO3
17.酸、碱、盐溶液能导电,是因为在水中解离出自由移动的离子。下列物质溶于水后所得溶液能导电的有
A.CO2 B.H2SO4
C.Cu(OH)2 D.BaSO4
18.在AlCl3溶于中逐渐加入NaOH溶液,现象是先产生沉淀,后沉淀逐渐消失。反应过程为AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+ NaOH=NaAlO2+2H2O。现取13.35%的AlCl3溶液100g,在其中加入15%的NaOH溶液100g,反应后溶液的溶质为
A.AlCl3 B.NaCl
C.NaAlO2 D.NaOH
第Ⅱ卷(非选择题 共64分)
三、填空与简答题(共5题,共32分)
19.(6分)碳在地壳中的含量不高,但它的化合物数量众多,而且分布极广。
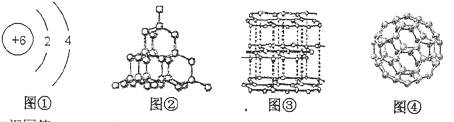
根据所学知识回答:
(1)图①为碳 原子的结构示意图,碳原子最外层电子数为 ,常温下碳的化学性质 ,(填“活泼”或“不活泼”)。
原子的结构示意图,碳原子最外层电子数为 ,常温下碳的化学性质 ,(填“活泼”或“不活泼”)。
(2)图②、③、④对应三种碳单质:图②单质的名称是 ,图③单质的名称是 ,图④单质的化学式是 。
(3)C为+4价,Cl为-1价,由C和Cl组成的化合物的化学式为 。
20.(6分)氯化钠是一种重要的盐,也是人生理活动必须的物质,根据所学知识回答:
(1)要检验生理盐水中的氯化钠,应选用的试剂是 (填化学式)溶液。
(2)除去粗盐中泥沙等不溶性杂质的操作过程为溶解、 和蒸发。
(3)可用NaOH除去粗盐中可溶性杂质MgCl2,反应的化学方程式为 。
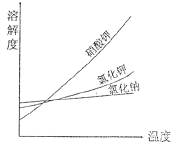
(4)右图为一些物质的溶解度曲线,其中氯化钠的溶解度曲线的特点是 ;采用冷却结晶的方法,能从氯化钠混合溶液中分离出来的 物质有 (从右图的物质中选填)。
物质有 (从右图的物质中选填)。
21.(6分)调味剂的主要作用是补充、增强或增加食品的味道。食醋是一种能增强食品酸味的调味剂,主要成分为醋酸(CH3COOH),与我们生活密切相联。根据所学知识回答:
(1)食醋能作酸味的调味剂,是因为醋酸在水溶液中能解离出CH3COO-,和
(填离子符号)。
(2)食醋的酸味能促进人胃酸的分泌,胃酸的成分是 (填化学式)。
(3)食醋能软化鱼骨和鸡蛋壳,原因是醋酸能与 (填化学式)反应。
(4)若NaOH溶液溅到皮肤上,应用水冲洗后,再用食醋清洗。清洗过程中发生反应的化学方程式为 。
(5)生活中常用酒来制取食醋,原理是酒中的CH3CH2OH在酶的作用下与空气中O2反应得到醋酸和另一种液体。已知在用酒制取食醋过程中,质量增加了16kg,则所得食醋中醋酸的质量为 kg。
22.(6分)合成氨是人类科学技术上得一项重大突破,对 社会发展与进步做出了巨大贡献。合成氨的工艺流程图如下:
社会发展与进步做出了巨大贡献。合成氨的工艺流程图如下:
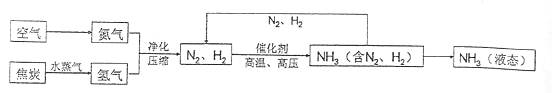
(1)合成氨需要的氮气来自空气,空气中氮气的体积分数约为 。
(2)制取氢气的反应过程为:C+H2OCO+H2,CO+H2OCO2+H2 。上述两个化学方程式中表现氧化性的物质是 (填化学式)。
(3)原料中N2、H2中常含有CO2和水蒸气,反应前要净化。净化的过程是
。
(4)写出N2、H2反应生成NH3的化学方程式 。
(5)将沸点不同的气体分离开来,常采用液化分离法。如,控制温度在-183℃时,可将空气中N2与O2分离。根据下表中物质的沸点判断,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在 ℃。
物质 | H2 | N2 | O2 | NH3 |
沸点 | -252℃ | -195.8℃ | -183℃ | -33.35℃ |
23.(8分)A是钠的氧化物,B、C、D、E是初中常见的盐。下图是这些物质的转化关系,部分反应物、生成物及反应条件已省略。
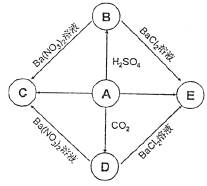
(1)请写出下列物质的化学式:C ,E 。
(2)A→B反应的化学方程式为 。
(3)可用D制烧碱,写出反应的化学方程式 。
(4)要将没有标签的B、C、D、E四种溶液区分开来,某同学设计了下列实验方案。方案中试剂①为 (填化学式,下同),试剂②为 溶液。
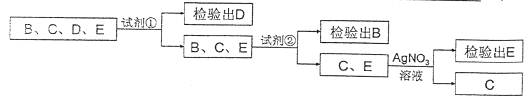
四、实验与探究题(共3题,22分)
24.(6分)炼铁的原理是利用一氧化碳与氧化铁反应,某同学利用该原理设计了一个实验,实验装置见下图:
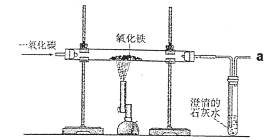
对实验进行分析并回答:
(1)给玻璃管加热的仪器叫酒精喷灯,要用其 (填“外焰”、“内焰”或“焰心”)进行加热。
(2)实验中玻璃管里氧化铁粉末的颜色变化是 ,观察到澄清石灰水的现象是 。
(3)实验前“通入CO”与“开始加热”的顺序是 ;
实验后“停止通入CO”与“停止加热”的顺序是 。
(4)实验要在装置末端a处燃着一盏酒精灯,其作用是 。
25.(9分)某学习小组围绕“气体实验室制取”进行了研讨。请你参与完成下面的问题。
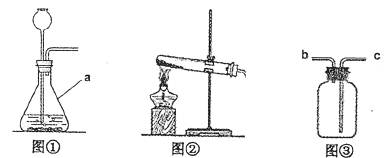
(1)原理分析:实验室制取CO2的化学方程式为 。
不用Na2CO3与盐酸反应制取CO2的原因是  。
。
(2)发生装置:图①装置中仪器a的名称是 。实验室常用无水醋酸钠固体与碱石灰在加热的情况下制CH4,应选图 (填序号)发生装置。
(3)收集装置:实验室收集NH3应采用的方法是 。收集有毒气体SO2时,常采用③收集装置,气体应从 (填字母)端通入。
(4)实验操作:用KMnO4制取O2的操作过程可概括为“组装仪器→ →
→加入试管→收集气体→停止加热”。
(5)实验反思:在加热KClO3制O2的过程中,发现产生O2的速率很慢,经检查不是KClO3变质,也不是装置气密性不好,你认为最可能的原因是 
。
26.(7分)漂白粉的主要成分为次氯酸钙 [Ca(ClO)2] 和氯化钙,即可用作漂白剂,又可用作消毒剂。漂白粉中有效成分是 [Ca(ClO)2] ,漂白的原理是:Ca(ClO)2在空气中发生反应
Ca(ClO)2+ CO2+ H2O=CaCO3↓+ 2HClO;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色。
(1)漂白粉是一种 (填“纯净物”或“混合物”)。
(2)HClO在常温下分解,反应为2 HClO=2HCl+ O2↑。某瓶HClO溶液放置一段时间后,溶液的pH (填“增大”或“减小”或“不变 ”)。
”)。
(3)在漂白粉中滴加盐酸,能加快漂白的速率。写出漂白粉中加入盐酸反应的化学方程式 。
(4)有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同 学设计了下列探究实验。
学设计了下列探究实验。
【提出问题】长时间放置的漂白粉是否变质?
【猜 想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为 ;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3。
【实验探究】限选试剂及仪器 :盐酸、石灰水、品红溶液、试管、带导管的单孔塞。
:盐酸、石灰水、品红溶液、试管、带导管的单孔塞。
实验操作 | 实验现象 | 实验结论 |
① ①取少量样品于试管中, | 有气体产生,气体使石灰水变浑浊。 |
猜想2成立 |
②在上述反应后的试管中 |
。 |
五、计算与分析题(共2题,共10分)
27.(3分)钙是人体必须的常量元素,每日必须摄入足够量的钙。目前市场上的补钙药剂很多,下图是某种品牌的补钙药品的部分说明书。
XX钙片
[药品规格] 每片含CaCO3 0.625g [用法用量] 每次一片,每天2次 |
请回答下列问题:
(1)CaCO3中钙元素的质量分数为 。
(2)若每片钙片的质量为1g,则钙片中钙元素的质量分数为 。
(3)如果按用量服用,每天摄入钙元素的质量为 g。
28.(7分)现有HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,
设计了如下实验方案:
【实验数据】实验共记录了两组数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g。
根据实验设计及有关数据进行分析与计算:
(1)混合溶液中HCl的质量分数为 。(只写结果)
(2)混合溶液中CaCl2的质量分数为多少?(写出计算过程)
(3)实验中混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为 。(不考虑过滤中的损失。只写结果,保留小数点后一位)
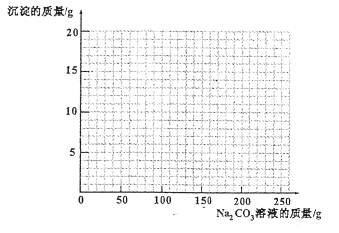
(4)若在100g混合溶液中不断加入10.6% 的Na2CO3的溶液,请你画出加入Na2CO3溶液的质量与产生沉淀的质量的关系图。(在答题卡的坐标图中作图)
2012年佛山市高中阶段学校招生考试
化学试卷参考答案及评分标准
三、填空与简答题(本题包括5小题,共32分)
19.(共6分,每空1分)
(1)4 不活泼 (2)金刚石 石墨 C60 (3)CCl4
说明:第⑴题完全正确才给分。第⑵题名称中有错别字不给分,C60书写不规范(如C60等)扣0.5 分。第⑶题书写不规范扣0.5 分。
20.(共6分,化学方程式2分,其余每空1分)
(1)AgNO3 (2)过滤 (3)MgCl2+2NaOH=Mg(OH)2↓+2NaCl
(4)氯化钠的溶解度受温度影响变化很小(意思相近即给分) 硝酸钾(或KNO3)
说明:第⑴题书写不规范扣0.5 分。第⑵题名称中有错别字不给分。第⑶题按方程式书写要求评分。第⑷题第1空意思对但不规范给0.5 分,第2空写名称或化学式均给分。
21.(共6分,化学方程式2分,其余每空1分)
(1)H+ (2)HCl (3)CaCO3
(4)CH3COOH+NaOH=CH3COONa+H2O (5)30
说明:第⑴⑵⑶题书写不规范扣0.5 分。第⑷题按方程式书写要求评分,其中CH3COONa写成了NaCH3COO或NaH3C2O2扣1分。第⑸题完全正确才给分,写“30kg”不扣分。
22.(共6分,化学方程式2分,其余每空1分)
(1)78%(或4/5) (2)H2O
(3)先把原料气通过NaOH溶液(或石灰水等碱液),再通过浓硫酸(或碱石灰等干燥剂)
(4)N2+3H2= 2NH3 (5)33.35
说明:第⑴题两个答案任填一个即给分。第⑵题书写不规范扣0.5  分。第⑶题答到“先通过某碱(为可溶性碱),再通过某干燥剂”即给分;只填“碱石灰”给满分;顺序不对
分。第⑶题答到“先通过某碱(为可溶性碱),再通过某干燥剂”即给分;只填“碱石灰”给满分;顺序不对 不给分,错其中一个扣0.5 分,只填一个不给分。第⑷题按方程式书写要求评分。第⑸题完全正确才给分。
不给分,错其中一个扣0.5 分,只填一个不给分。第⑷题按方程式书写要求评分。第⑸题完全正确才给分。
23.(共8分,化学方程式2分,其余每空1分)
(1)NaNO3 NaCl (2)Na2O+ H2SO4=Na2SO4+ H2O(或
(3)Na2CO3+ Ca(OH)2=CaCO3↓+ 2NaOH(或Na2CO3+ Ba(OH)2=BaCO3↓+ 2NaOH)
(4)HNO3(或H2SO4、HCl、CH3COOH等) Ba(NO3)2(或BaCl2、Ba(OH)2等)
说明:第⑴题写名称不给分,书写不规范扣0.5 分。第⑵题写2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑也正确,按方程式书写要求评分。第⑶题两个方程式均正确,按方程式书写要求评分。第⑷题两空各填对其中一种即给分,书写不规范扣0.5 分。四、实验与探究题(本题包括3小题,共22分)
24.(共6分,每空1分)
(1)外焰 (2)红色粉末变黑色 石灰水变浑浊 (3)先通入CO再开始加热 先停止加热再停止通入CO (4)除去反应剩余的CO(或防止CO污染)
说明:第⑴题完全正确才给分。第⑵题表达要准确,答到“变黑色”、“生成沉淀”等关键点即给分。第⑶题回答顺序错误不给分,用“先”或“后”描述即给分。第⑷题要答到关键点,如“防止污染空气”、“尾气处理”等意思相近即给分,答“消除尾气”给0.5 分。
25.(共9分,化学方程式2分,第⑷题1分,其余每空1分)
(1)CaCO3+2HCl=CaCl2+H2O+CO2↑ 反应快,不易控制 (2)锥形瓶 ②
(3)向下排空气法 c (4)检查气密性 装入药品 (5)未加MnO2(或未加催化剂)
说明:第⑴题第1空按方程式书写要求评分,第2空“反应快”、“不易控制(或难以收集)”两个关键词各0.5 分。第⑵⑶题完全正确才给分。第⑷题每空各0.5 分,分开给分,顺序调换不给分。第⑸题关键词在“未加MnO2(或未加催化剂)”上,意思相近即给分,错别字扣0.5 分。
26.(共7分,化学方程式2分,其余每空1分)
(1)混合物 (2)减小 (3)Ca(ClO)2+2HCl=CaCl2+2HClO
(4)【猜 想】猜想2:CaCl2、Ca(ClO)2、CaCO3
【实验探究】实验操作①:加入适量盐酸,塞上带导管的单孔塞,把导管插入另一试管里的石灰水中。 实验现象②:品红溶液褪色
说明:第⑴⑵题完全正确才给分。第⑶题按方程式书写要求评分。第⑷题“猜想2”全对才给分,书写不规范扣0.5 分;实验操作①表述正确所选试剂给0.5 分,表述正确仪器及操作给 0.5 分,将“盐酸”写成“HCl”不扣分;实验现象②的给分点在“品红溶液褪色”上,填“变浅”给0.5 分。
0.5 分,将“盐酸”写成“HCl”不扣分;实验现象②的给分点在“品红溶液褪色”上,填“变浅”给0.5 分。
五、计算与分析题(本题包括2小题,共10分)
27.(共3分,每小题1分)
(1)40% (2)25% (3)0.5
说明:完全正确才给分,写成“0.4”、“0.25”不给分,写“0.5g”不扣分。
28.(共7分)
(1)7.3%(1分)
(2)(共4分,设未知数、作答和单位共0.5分,化学方程式0.5分,建立关系式1分,x结果1分,质量分数计算1分)
解:设混合溶液中CaCl2的质量为x。
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 100
| 111 x 100 10g
|
x 10g
| 1分
|
x = 11.1g
 混合溶液中CaCl2的质量分数=(11.1g÷100g)×100%11.1%
混合溶液中CaCl2的质量分数=(11.1g÷100g)×100%11.1%
答:混合溶液中CaCl2的质量分数为11.1%。
(3)8.2%(1分)
(4)作图见右图曲线(共1分)
说明:第⑴题完全正确给1分。第⑵题共计4分:设未知数、作答和单位共0.5分,化学方程式0.5分,建立关系式1分,x结果1分,质量分数计算1分。未知数设计合理均给分(如设为x或xg均可);未知数设计错误、无作答(答案的数据错误,不影响给分)和单位运算错误中有1项即扣0.5分;只写化学反应方程式,且正确给0.5分;相对分子质量计算错误的,只在计算结果上扣分,不影响关系式的评分;用“关系式”法来运算的,只要合理并正确的均给分;只有答案(没有计算过程)的情况不给分。第⑶题完全正确给1分,填8.193%不扣分。第⑷题抓住起点、折点及曲线走势评分,错一处不给分;曲线两段均为直线,偏差太大不给分;在起点、折点及曲线走势没有错误的情况下,画得不到位(如只画到Na2CO3溶液质量为200g处,且正确)的给0.5分。


