(单词翻译:单击)
一、选择题(本题包括8小题,共2 4分。每小题只有一个选项符合题意)
1.下列物质富含糖类的是
A.空心菜 B.鸡蛋 C.面条 D.花生油
2.下列变化中,属于化学变化的是




A B C D
3.下列环境问题与二氧化硫的排放有关的是
A.白色污染 B.臭氧层破坏 C. 酸雨 D.温室效应
4.下图所示的化学实验基本操作中,错误的是




A.倾倒液体 B.量取液体 C.点燃酒精灯 D.滴加液体
5.金属钛是制造眼镜架的常用材料。下面是冶炼钛过程中的一个重要反应:4Na + TiCl4 Ti + 4 NaCl,该反应的基本类型是
Ti + 4 NaCl,该反应的基本类型是
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
6.下列有关水的说法错误的是
A.自来水是混合物
B.水蒸发时水分子的体积会变大
C.降低水的硬度可用煮沸的方法
D.软水和硬水可用肥皂水区别
7.在森林火灾中,防火隔离带起的主要作用是
A.隔绝空气 B.隔离可燃物 C.便于运水 D.降低可燃物着火点
8.金刚石和石墨的结构如下图所示(小圆圈代表碳原子)。下列关于金刚石和石墨说法正确的是
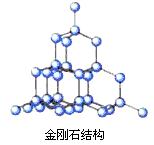
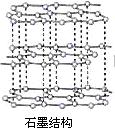
A.两者为同种物质
B.原子排列方式相同
C.在氧气中完全燃烧后的产物都是二氧化碳
D.都有良好的导电性
二、选择填充题(本题包括4小题,共12分。先在A、B、C中选择一个正确选项,然后在D处再补充一个符合题意的答案填在横线上)
9.用于鉴别HCl溶液和Ca(OH)2溶液的试剂或方法是
A.观察颜色 B.NaCl溶液
C.酚酞溶液 D.
10.下列由Na、H、O、S、Al中的元素组成的物质,属于氧化物的是
A.H2SO4 B.Na2O
C.Al(OH)3 D.____________
11.某微粒的结构示意图如右图所示。从中获得该微粒的信息正确的是
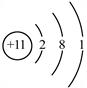
A.该微粒的原子核内有11个质子
B.该微粒在化学反应中不易失去电子
C.能确定其单质物质的密度
D.
12.伦敦奥运会即将开幕,兴奋剂问题再次引起大家关注。诺龙是兴奋剂中的一种,其化学式是C18H26O2 。下列关于诺龙的说法正确的是
A.诺龙中含有氧分子 B.诺龙中碳、氢、氧元素质量比为9:13:1
C.一个诺龙分子中含有46个原子 D.
三、填空与简答(本大题包括3小题,共26分)
13. (6分)
(1)用化学用语表示:
①2个氧原子__ __。
②氯化钙中氯离子符号__ __。
③天然气的主要成分__ __。
(2)硝酸见光易发生如下分解反应:4HNO3 2X+4 NO2↑+O2↑。
①X的化学式为 __。
②NO2中N元素的化合价为___ __。
③硝酸应__ _____保存。
14.(13分)
K2CO3和KNO3是重要的盐类物质。其溶液应用广泛。
Ⅰ.(1)K2CO3溶液的酸碱性和Na2CO3溶液相似,能使无色酚酞溶液变 色。
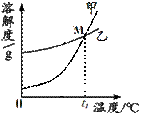
(2)K2CO3和KNO3在不同温度时的溶解度如下:
温度/℃ | 20 | 30 | 50 | 60 | 80 | |
溶解度/g | K2CO3 | 110 | 114 | 121 | 126 |
|
KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
①右图中表示KNO3溶解度曲线的是 (填“甲”或“乙”)。
②20℃时,K2CO3饱和溶液中溶质与溶剂的质量比为 。
Ⅱ.某KNO3样品中含有少量K2CO3,其提纯流程如下:
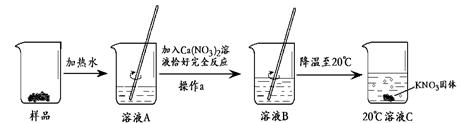
(1)溶液A加入适量Ca(NO3)2溶液,与溶液中K2CO3恰好完全反应,生成CaCO3沉淀和KNO3,写出该反应的化学方程式: 。
(2)操作a的名称是 。
(3)20℃时溶液C是 (填“饱和溶液”或“不饱和溶液”)。
15.(7分)
甲、乙、丙为初中化学常见物质,它们转化关系如右图所示:
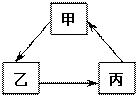
(1)若甲、乙、丙均含同一种非金属元素,甲是石灰石的主要成分,则甲为 ,乙为 ,丙为 。
(2)若甲、乙、丙均含同一种金属元素,甲为红色金属单质, 乙是甲的氧化物,则乙为 ,写出一个符合丙→甲转化关系的化学方程式: 。
四、实验与探究(本大题包括2小题,共30分)
16.(13分)
请结合下列装置图回答问题:
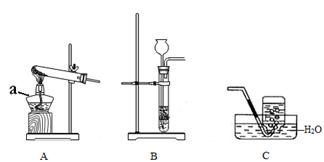
Ⅰ.(1)仪器a的名称是 。
(2)写出一种可使用C装置收集的气体 。
Ⅱ.(1)实验室常用H2O2在二氧化锰催化作用下制取O2,选用的发生装置是 (填序号)。
(2)写出H2O2在二氧化锰作用下分解的化学方程式: 。
(3)FeCl3和CuSO4都可作为H2O2分解的催化剂。右图1
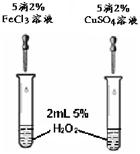
是探究FeCl3和CuSO4对H2O2分解催化效果的实验,可通过观察 (填现象),判断两者的催化效果。
Ⅲ.
(1)写出实验室制取CO2的化学方程式: 。
(2)要验证CO2不支持燃烧、密度比空气大的性质,认为用右图2的 (填“甲”或“乙”)实验操作方法效果更好(夹持装置已略)。

17.(17分)
镁铝合金强度大、密度小,合金表面易上色,常用作笔记本电脑的外壳。
Ⅰ.(1)形状大小相同的铝和镁,分别放入同样的盐酸溶液中,下列说法不正确的是(填序号)。
A.两者都发生反应 B.镁比铝反应剧烈 C.铝不与盐酸溶液反应
(2)镁与氢氧化钠溶液不反应, 而金属铝能与氢氧化钠、水共同作用生成易溶于水的钠盐(用化学式NaAlO2表示)和H2,写出该反应的化学方程式: 。
Ⅱ.三位同学通过进行如下途径探究,来推算某铝镁合金(假设不含其它杂质)中铝的质量分数。

方案一:镁铝合金与氧气反应,测定参与反应的氧气体积。如右图所示,称量一定量镁铝合金粉末,在足量的氧气中充分燃烧,冷却至室温,打开止水夹。参与反应的氧气体积与 相等。
方案二:铝镁合金与盐酸反应,测定生成气体的体积。装置如右图所示。
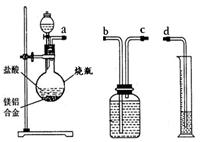
(1)通过排水法测定所收集到的氢气体积,装置导管口a、b、c、d的连接顺序是:
 a→
a→
(2)反应结束,冷却至室温。烧瓶内还留有气体,对实验结果 (填“有”或“没有”)影响。

方案三:铝镁合金与氢氧化钠溶液反应,测定剩余固体质量。称取8g镁铝合金样品,把60g氢氧化钠溶液平均分成三份依次加入样品中,反应过程如下图:
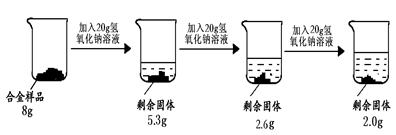
(1)实验中所加的氢氧化钠溶液应过量,其目的是 。
(2)从上图数据可知,该合金中镁元素与铝元素的质量比为 。
【反思与拓展】利用铝镁合金中铝与氢氧化钠溶液反应反应和方案二装置,通过测定 体积,也可得出合金中铝的质量。
五、计算题(本题8分)
18.化学兴趣小组对某工业废水(含有H2SO4、Na2SO4)中H2SO4的含量进行测定。甲、乙两同学各提出不同的测定方法:
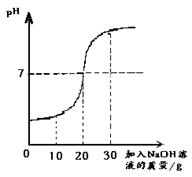
(1)甲同学:酸碱中和法
取60g废水于烧杯中,逐渐滴入溶质质量分数为10%的NaOH溶液(反应的化学方程为:H2SO4+2NaOH==Na2SO4+ 2H2O),反应过程溶液pH变化如右图, 求60g废水中H2SO4的质量。
(2)乙同学:沉淀分析法
改用BaCl2溶液代替NaOH溶液测定废水中的H2SO4的含量(反应的化学方程式为:H2SO4+BaCl2==BaSO4↓+2HCl),你认为结果会 (填“偏高”、“偏低”、“不变”)理由是 。
一、选择题(每小题3分,共24分。)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
答案 | C | A | C | D | D | B | B | C |
二、选择填充题(每小题选择2分,填充1分,共12分)
题号 | 9 | 10 | 11 | 12 |
答案 | C | B | A | C |
9. CO2、石蕊溶液等合理答案;
10.H2O、SO2等合理答案;
11.该微粒在化学反应中易失去电子等合理答案;
12.诺龙中碳、氢、氧元素的质量比为108:13:16等合理答案;
三、(本大题包括3小题,共26分)
13. (每空1分,共6分)
(1)①2O ②Cl- ③CH4
(2)①H2 O ②+4 ③密封 避光
14.( 13分)
Ⅰ.(1)红 (2分)
(2)①甲 (2分) ②11:10(2分)
Ⅱ.(1)Ca(NO3)2+K2CO3 =CaCO3↓+2KNO3(3分)
(2)过滤 (2分)
(3)饱和溶液 (2分)
15.(7分)
(1)CaCO3 CaO Ca(OH)2 (或 CaCO3 CO2 Na2CO3等合理答案)(每空1分)
(2)CuO (1分) CuSO4+Fe=FeSO4+Cu等合理答案 (3分)
四、实验与探究(本大题包括2小题,共30分)
16.(13分)
Ⅰ.(1)酒精灯(1分)
(2)O2等 (1分)
Ⅱ.(1)B (1分)
(2)2H2O2  2H2O+O2↑ (3分)
2H2O+O2↑ (3分)
(3)产生气体的速率快慢 (2分)
Ⅲ .(1)CaCO3 + 2HCl = CaCl2 + CO2↑+ H2O (3分)
(2)甲 (2分)
17. (17分)
Ⅰ.(1)C (2分)
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑ (3分)
Ⅱ.方案一 量筒内水减少的体积 (2分)
方案二(1)c→b→d(2分)
(2)无(2分)
方案三(1)使镁铝合金中的铝完全反应(2分) (2)1:3 (2分)
【反思与拓展】氢气(2分)
五、计算题(本题8分)
18. (1) 解:设废水中硫酸的质量为x
H2SO4+2NaOH=Na2SO4+2H2O
98 80
x 20g×10%
98/80=X/20g×10% (2分)
X=2.45g (1分)
答:废水中硫酸的质量为2.45g
(2)偏高(1分) BaCl2溶液也会与废水中的Na2SO4反应。(2分)

 139
139
