(单词翻译:单击)
第Ⅰ卷(选择题 共16分)
一、选择题(下列各题只有一个正确的选项。其中,1~4小题个1分,5~10小题各2分,本大题共16分)
1. 黄金是一种贵重金属,它不仅被视为美好和富有的象征,而且还以其特有的价值造福与人类。常言说:“真金不怕火炼”主要是指
A. 熔点高 B. 延展性好 C. 有金属光泽 D. 化学性质稳定
2. 下列各组物质都属于氧化物的是
A. 氮气、空气 B. 水、双氧水 C. 烧碱、纯碱 D. 生石灰、熟石灰
3. 对下面一些现象和事实的解释,错误的是
A. 用活性炭去除冰箱异味 活性炭有吸附性
B. 蜡烛一吹即灭 冷空气降低了蜡烛的着火点
C. 用洗洁精去除餐具油污 洗洁精有乳化作用
D. 铝质饭盒不宜贮存酸性食品 铝易与酸性溶液反应
4. 下列反应不属于化学反应基本类型的是
A. NH4HCO3=NH3↑+CO2↑+H2O↑
B. CaCO3+CO2+H2O=Ca(HCO3)2
C. 2NaCl+2H2O=2NaOH+H2↑+Cl2↑
D. 2Mg+CO2=2MgO+C
5. S2-、SO32-和SO42-是比较常见的离子。对这三种离子的认识正确的是
A. 三种离子中都含有硫元素
B. SO32-和SO42-都属于氧化物
C. 硫元素在化合物中的化合价有-2、+4、+6
D. S2-和H+不能结合成酸分子
6. 工业上以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠(粗产品为二者混合物),请分析右图氯化铵和硫酸钠的溶解度曲线并判断,以下说法不正确的是
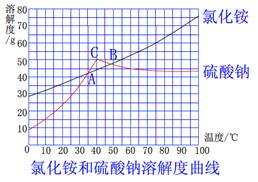
A. 曲线上C点两侧,硫酸钠的溶解度随温 度变化趋势不同
B. 曲线上A、B两点,对应温度下氯化铵 与硫酸钠溶解度相同
C. 结晶法分离出氯化铵,温度应控制在40℃以上
D. 结晶法分离出氯化铵后的母液是硫酸钠溶液
7. 利用“→”上方的试剂可实现下列各组物质间转化的是
A.Cu→CuCl2 B.K2CO3→KOH
C.Na2SO4→Na2CO3 D.Cu(OH)2→NaOH
8. 分离、除杂、提纯和检验是化学实验的重要环节。下面实验设计能够达到目的的是
实验内容 | 实验设计 | |
A | 除去H2中少量水蒸气、HCl | 先通过浓H2SO4,再通过NaOH溶液 |
B | 提纯久置变质的NaOH溶液 | 加入足量CaCl2溶液,充分反应后,过滤 |
C | 验证某溶液为稀盐酸 | 先测溶液的pH﹤7,再加入锌粒 |
D | 分离CO2、CO混合物 | 先用NaOH溶液吸收掉CO2分离出CO,再向该NaOH溶液加足量稀盐酸“释放”出CO2 |
9. 某同学为探究镁、锌、铜、银的活动性顺序,设计如下实验流程:
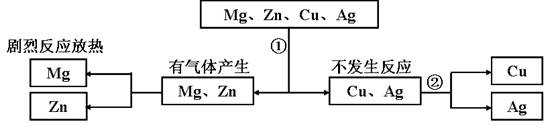
依据该流程设计,下面对物质①、②的选择合理的是
A. ①稀硫酸 ②硫酸铜 B. ①稀盐酸 ②硫酸锌
C. ①稀盐酸 ②硫酸亚铁 D. ①稀硫酸 ②氯化镁
10. 实验废液中可能含有离子K+、Mg2+、Cl-、Ba2+、SO42-、CO32-中的几种,为确定可能含有的离子,兴趣小组进行了下面的实验:
①取一份废液,加入氯化钡溶液有白色沉淀产生,再加入足量稀盐酸,沉淀无变化;
②另取一份废液,加入氢氧化钾溶液出现白色沉淀,再加入足量稀盐酸,沉淀全部溶解。
分析上面实验得出的结论中,正确的是
A. 只含有Mg2+、SO42-
B. 一定含有K+、Mg2+、Cl-、SO42-
C. 一定含有Mg2+、SO42-,可能含有Cl-、K+
D. 一定含有Cl-、K+,可能含有Mg2+、SO42-
第Ⅱ卷(非选择题 共34分)
二、填空与简答(共17分)
11.(4分)下面是几种常见粒子的符号和示意图,读识符号和示意图完成下列问题(用符号或化学式表示,多个答案必须选全):
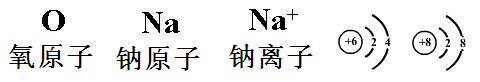
⑴属于原子的有__________;
⑵属于离子的有__________;
⑶由原子构成的分子有__________;
⑷由离子构成的化合物有__________;
12.(4分)日常生活中的不少用品与水银有关,体温计就是其中之一。小明偶患感冒,量体温时不小心将体温计滑落摔碎,地面上散落许多水银珠。小明就想:水银有毒吗?怎样清理?经网络搜寻,小明获取以下有关水银的资料:

水银学名为汞(Hg),常温下是银白色液体,密度大,易蒸发且吸附性特别好,不溶于水,汞及汞的大多数化合物有毒。汞在化合物中常表现为+2价,能与硫反应生成不易溶于水的无毒物质——硫化汞。
依据以上信息和小明的做法,完成下面问题:
⑴小明关掉室内所有热源,开窗通风,这样做的目的是__________;
⑵小明戴上手套以避免__________,用小勺把水银收集到盛有__________的玻璃瓶中,送交实验室。
⑶最后,小明又向不易收集的细小水银珠上布撒硫磺粉降低危害,他的依据是__________(用化学方程式表示)。
13.(4分)某实验小组探究酸的化学性质,在做盐酸除铁锈的实验时发现:

⑴将带锈铁钉放入试管后加入稀盐酸,看到铁锈消失,溶液呈黄色,反应的化学方程式为__________,待铁锈消失后又看到__________ 现象。
⑵课后清洗仪器时,一同学发现试管中的黄色溶液变成浅绿色,表明此时的溶液已变为__________溶液。这是由于过量的铁继续与黄色溶液的主要成分反应造成的,该反应的化学方程式为__________。
14.(4分)一包白色粉末由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的三种混合而成。为探究其组成,进行以下实验:
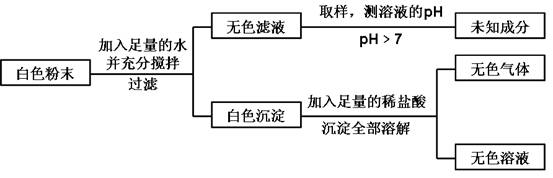
分析实验过程,回答:
⑴白色粉末中一定有__________ ,一定没有__________;
⑵白色粉末三种成分的可能组合为:__________,__________。
15.(1分)早期食品长期保存的方法主要是烟熏和盐腌。随着社会发展,保存的措施越来越多,大家熟悉的有:充填气体、放置干燥剂、脱氧剂和添加防腐剂等。下面是生活中常见的食品保存方法,其中,通过隔绝空气这一措施保存的是
①市售榨菜丝用真空袋包装
②火腿肠制作中添加防腐剂山梨酸钾
③蔬菜用保鲜膜密封后存放在冰箱内
④月饼包装袋中附有抗氧剂“铁粉”包
⑤膨化食品用填充氮气的塑料袋包装
三、实验与探究(共11分)
16.⑴(6分)实验室中,我们通常使用下面三种方法来制取氧气;
2H2O2=2H2O+O2↑
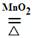
2KClO3 2KCl+3O2↑
2KMnO4=K2MnO4+MnO2+O2↑
下图是气体制备时的常用装置:
根据你对上述内容的理解,回答下列问题:
①装置C的名称是__________;
②一般采用双氧水制取氧气的理由是__________;
③采用高锰酸钾制氧气选用的发生装置是__________;
④采用氯酸钾制得的氧气有刺激性气味,是因为氯酸钾分解时会产生少量的氯气。可利用__________(填序号)装置,并向其中加入__________液除去;
⑤三种制氧方法中都出现二氧化锰,他们的作用有何不同?
信息提供:
氯气有毒,会对上呼吸道黏膜造成伤害,症状严重时会致人死亡,少量氯气可通过碱溶液除去。
⑵(5分)苏打水是碳酸氢钠(NaHCO3)的水溶液,有弱碱性。医学上外用可消毒杀菌,饮用可改变酸性体质,保持人体内的酸碱平衡。右图是某品牌苏打水的图片和配料表,读图完成下面问题:

①根据配料表可以发现:苏打水成分中的无机物有__________,有机物有__________(每空至少填写两种物质);
②请你设计实验证明该品牌苏打水含有碳酸氢钠:
实验步骤 | 实验现象 | 实验结论及化学反应方程式 |
四、分析与计算(共6分)
17.(2分)熟话说“酒是陈的香”。白酒的主要成分是乙醇,把酒密封好埋在地下窖藏几年后,其中的乙醇就和白酒中少量的乙酸发生反应,生成一种具有浓郁果香味、名叫乙酸乙酯(CH3COOC2H5)的物质。上述反应速度较慢,因此,窖藏时间越长,乙酸乙酯含量越多,酒就越醇香。
阅读上面的信息后回答:
⑴乙酸乙酯分子中C、H、O三种原子的个数比为__________。
⑵乙酸乙酯中__________元素的质量分数最大。
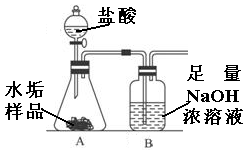
18.(4分)长期使用的水壶底部都结有一层水垢,其主要成分是碳酸钙和氢氧化镁。为较准确测定水垢中氢氧化镁的含量,实验小组分别取三份同样的水垢样品各7.00g,利用右图所示装置连续进行三次实验,并将每次实验中装置B的质量变化记录于下表:
第一次 | 第二次 | 第三次 | 平均值 | |
B装置增加的质量(g) | 2.17 | 2.22 | 2.21 |
分析上面实验与数据后,回答:
⑴第一次实验测得数据较低的原因是__________;
⑵平均每份水垢样品中碳酸钙的质量为__________克;
⑶水垢样品中氢氧化镁的平均质量分数为__________。(计算结果精确到0.1)


