(单词翻译:单击)
一、选择题(本大题包括10个小题,每小题2分,共20分。每小题只有一个正确答案,请在答题卡选择题栏内用2B铅笔将对应题目答案的标号涂黑。)
1.使用下列能源会造成环境污染的是
A.煤B.风能 C.太阳能 D.地热能
2.下列变化属于物理变化的是
A.铁的冶炼B.光合作用C.火药爆炸。D.工业制氧
3.下列反应有刺激性气味气体生成的是
A.铁丝在氧气中燃烧.B.硫粉在氧气中燃烧
C.红磷在空气中燃烧D.甲烷在空气中燃烧
4.遵义盛产茶叶,新鲜茶叶用沸水冲泡后会散发清香,说明了
A.分子可以再分B.分子间有间隙
c.分手的质量很小D.分子不停运动
5.粗盐初步提纯的操作步骤如下图所示。相关说法错误的是

A.溶解时玻璃棒用于搅拌B.过滤时玻璃棒用于引流
C.蒸发至滤液被蒸干后再移去酒精灯D.图巾“操作l”是称量
6.下列有关金属的说法正确的是
A.铝有良好的抗氧化能力B.合金一定不含非金属
C.生铁是化合物D.赤铁矿是金属材料
7.分类是化学学习和研究的重要方法之一,下列分类不正确的是
A.空气污染物:NO2、SO2、PM2.5…B.混合物:铁锈、碘酒 、稀有气体…
、稀有气体…
C.酸:H2SO4、HNO3、NaHCO3… D.人体所需营养素:糖类、蛋白质、油脂…
8.欲除去不纯物质中的杂质(括号内为杂质),所选试剂正确的是
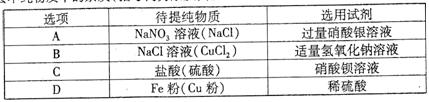
9.物质M在不同温度下的溶解度数据如下表所示,以下说法正确的是

A.0℃时,15.9gM溶于150g水中形成饱和溶夜
B.20T;时,M形成饱和溶夜的溶质质量分数是15.3%
C.若要配制200.0g20.0%的M的饱和溶液,对应温度必须是60℃
D.80%时,M的饱和溶夜138.2g降温至40℃,析出晶体的质量大于20.0g
10.下列叙述与对应的坐标图表示正确的是
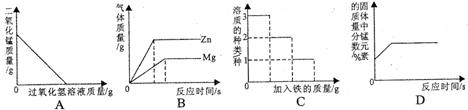
A.向一定量的二氧化锰中加入过氧化氢溶液
B.将相同质量的Zn粉和Mg粉分别加入足量的稀盐酸中
C.在一定量AgNO3和Cu(NO 3) 2的混合溶液中加入铁粉
3) 2的混合溶液中加入铁粉
D.加热一定量的高锰酸钾固体
二、非选择题(本大题包括8 个小题,11~17小题每空1分,18小题5分,共40分。请将下列各题应答内容,填写到答题卡相应题号的空格内。)
11.用所学知识回答下列问题。
(1)用锅盖盖灭着火的油,灭火原理是___________;
(2)硬水软化的简单方法___________;
(3)KNO3可用作化肥,属于___________(填“氮”、“磷”、“钾”或“复合”);
(4)化学实验应严格规范,确保安全。实验室稀释浓硫酸的正确方法是___________。
12.化学用语是研究化学的工具。按要求回答下列问题:
(1)如图是氧元素的原子结构示意图: 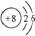
①氧原子的最外层电子数为___________,
②氢离子的符号为___________
(2)下图是某反应的微观示意图。
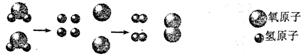
①该化学变化过程中,一定不能再分的微粒是___________(用化学用语表示);
②该反应的化学方程式是___________。
13.2012年一些厂商将工业明胶制成药用胶囊,受到严 厉查处。生产过程有以下几步。
厉查处。生产过程有以下几步。
①废弃皮革②生石灰浸泡③清水清洗④盐酸清洗⑤鞣制
鞣制过程使用有毒的物质碱式硫酸铬,化学式为Cr(OH)SO4。完成下列问题。
(1)①Cr(OH)S04中Cr的化合价为___________,②该物质由___________种元素组成,
③Cr(OH)S04中氢、氧元素的质量比为___________;
(2)写出生产过程中放热、而且是化合反应的化学方程式___________。
14.“碳循环”是自然界中重要的一类物质转化,CO2在该转化中起着非常重要的作用。下图是这种作用的具体体现之一。
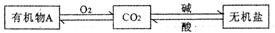
(1)如果A是葡萄糖(C6 H12 O6),它的分子中碳、氢、氧原子个数比为___________;
(2)自然界中“碳循环”的“碳”是指___________(选填“单质 ”、“元素”、“原子”);
”、“元素”、“原子”);
(3)某有机物R在空气中完全燃烧的化学方程式:R+3O2 2CO2+3 H2O,R的化学式为___________
(4)碳酸钾是无机盐,写出碳酸钾与盐酸反应的化学方程式___________;
(5)科学家用NaOH溶液喷淋吸收CO2 (如下图)。对该方 法的叙述正确的是___________。
法的叙述正确的是___________。
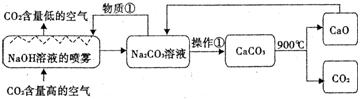
A.该方法中包含分解反应_、置换反应等B.物质是①是Na2C03溶液
C.操作①是蒸发浓缩、降温结晶D.整个过程至少有两种物质可以循环利用
15.硫酸铜常用作农业杀虫剂。下图是利用含铁废铜料生产硫酸铜的工艺,回答相关问题。
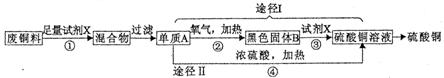
(1)试剂X的化学式是___________;
(2)途径I中,反应③的化学方程式为,途径Ⅱ中,反应④的化学方程式为:Cu+2H2 SO4(浓)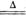 CuSO4+SO2↑+2H2O,从环保和经济的角度分析,利用途径 (填“I”或“Ⅱ”)制取硫酸铜更合理;
CuSO4+SO2↑+2H2O,从环保和经济的角度分析,利用途径 (填“I”或“Ⅱ”)制取硫酸铜更合理;
(3)通常情况下不反应的两种物质,在改变温度和 后,也可能发生反应。如果用足量的铜与20.0g溶质量分数为98.0%的浓硫酸在加热条件充分反应,实际生成二氧化硫的质量是___________(选填字母)。
A.小于6.4gB.等于6.4gC.大于6.4g
16.根据下列装置,结合所学化学知识,回答下列问题。
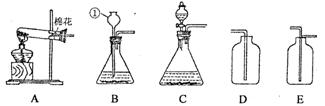
(1)写出图中标号为①的仪器名称___________;
(2) 实验室用高锰酸钾制取氧气的发生装置选用___________,化学方程式为___________;收集O2的装置最好选用(填字母编号),用该装置验满O2的方法是___________;
实验室用高锰酸钾制取氧气的发生装置选用___________,化学方程式为___________;收集O2的装置最好选用(填字母编号),用该装置验满O2的方法是___________;
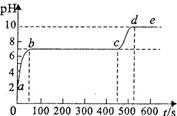
(3)用块状石灰石和稀盐酸反应,观察到气泡逸出不明显后,测得B中锥形瓶内残留液的pH等于2,然后取适量该残留液,逐滴滴人碳酸钠溶液,并用pH计连续监测得曲线如右[pH为纵坐标,时间S(秒)为横坐标],请写出.曲线中bc段的化学方程式,cd段上升的原因是___________。
17.氧化铜能与多种物质反应,能否与氨气(NH3)反应呢?在老师的指导下,某同学进行了探究。(注:无水硫酸铜遇水变蓝)
【实验设计】按下图设计组装好仪爷,检查气密性,装入药品。
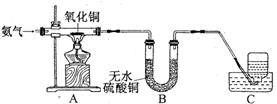
【进行实验】(1)A中氧化铜全部转化成光亮的红色固体;
(2)B中U形管内物质变蓝;
(3)C中集气瓶内收集到一种无色气态单质,该气体用排水法收集的理由是___________;
(4)从C中水槽里取适量液体于试管,向试管里滴人无色酚酞试液,溶液呈色,原因是___________;
【实验结论】氧化铜能和氨气发生反应,化学方程式是___________。
【继续探究】(1)测得有关数据如下 表
表

在此反应中,参加反应的氧化铜质量为___________g;
 (2)A中玻璃管内的反应证明,氨气的化学性质与___________有相似之处(填物质化学式)。
(2)A中玻璃管内的反应证明,氨气的化学性质与___________有相似之处(填物质化学式)。
18.将氢氧化钠固体投入到200.Og一定溶质质量分数的稀硫酸中,恰好完全反应,所得溶液的质量为208.0%。请计算所用稀硫酸的溶质质量分数。
一、选择题(本大题共10个小题.-每小题2分,共20分)
1.A2.D3.B4.D5.C
6.A7.C8.B9.C10.D
二、非选择题(1~17小题每空1分,18小题5分,共40分)
1 1.(1)隔绝氧气(或空气)
(2)煮沸(或蒸馏)
(3)复合
(4)把 浓硫酸沿烧杯壁缓缓注入水中,并用玻璃棒不断搅拌。(把浓硫酸缓缓注人盛有水的烧杯中,用玻璃棒引流并不断搅拌)(答案合理即可)
浓硫酸沿烧杯壁缓缓注入水中,并用玻璃棒不断搅拌。(把浓硫酸缓缓注人盛有水的烧杯中,用玻璃棒引流并不断搅拌)(答案合理即可)
12.(1)①6 ②O2-
(2)①H、O(符号多答少答不给分)
②2H2O 2H2↑+O2↑
2H2↑+O2↑
13.(1)①+3 ②4 ③1:80
(2)CaO+H2O==Ca(OH) 2
14.(1)6:1 2:6(或1:2:1)
(2)元素
(3)C2 H5 OH(或C2 H6 O等)
(4)K2CO3+2HCl=2KCl+H2O+CO2↑
(5)D
15.(1)H2SO4 (或稀H2SO4)
(2)CuO+H2SO4==CuSO4+H2 OI
OI
(3)浓度A
16.(1)长颈漏斗
(2)A
2KMnO4 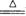 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
E
把带火星的木条放在瓶口,如果复燃,证明O2,已满。
(3)Na2CO3+CaCl2 ===CaC3↓+2NaCl
过量的Na2 CO3使溶液呈碱性
17.【进行实验】(3)该气体难溶于水(或不易溶于水),且不与水反应。
(4)红
未反应的氨气会随氮气排出,溶于水显碱性,使无色酚酞试液变红。
【实验结论】2NH3+3CuO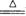 3cu+N2+3 H2O
3cu+N2+3 H2O
【继续探究】(1)32.0g
(2)CO(或H2、或C)
18.解:参加反应的氢氧化钠固体的质量:208.0g-200.0g=8.0g………………(1分)
设参加反应的H2SO4的质量为x:
2NaOH+H2 SO4====-Na2 SO4+2H2O……………………………………………(1分)
80 98
8 .0g x
x
=……… ……………………………………………………………(1分)
……………………………………………………………(1分)
x =9.8 g…………………………………………………………………(1分)
×100%=4.9%…………………………………………… ……………(1分)
……………(1分)
答:稀硫酸的溶质质量分数为4.9%。


