(单词翻译:单击)
第I卷(选择题共66分)
第I卷共28题,每题只有一个选项最符合题意。l~10题为生物题,ll~18题为化学题,19~28题为物理题。l~18题每题2分,l9--28题每题3分。
11.下列变化中,包含有化学变化的是 ( )
A.轮胎爆炸B.米饭变馊C.海水晒盐D.干冰升华
12.如图所示的操作中均有错误,其中要改正错误但不需要补充仪器的是 ( )
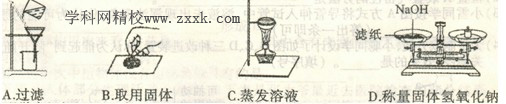
13.物理学家组织网2013年4月10日报道,美国首次研制出了稳定的单电子层锗,可取代硅制造更好的晶体管。其相关信息如右图所示
关于锗的说法中正确的是 ( )

A.锗元素的相对原子质量为72.64g
B.锗原子的核内有32个中子
C.锗原子的核内有32个质子
D.锗原子的最外层电子达到了相对稳定结构
14.下列说法中错误的是 ( )
A.湿衣服在阳光下干得快,说明温度越高,分子运动速率越快
B.水沸腾后壶盖被顶起来,说明温度升高,分子的体积变大
C.水在通电条件下生成了氢气和氧气,说明水是由氢元素和氧元素组成的
D.氯化钠是由氯离子和钠离子构成的
物质 | M | N | P | Q |
反应前质量/g | 3.4 | 0.8 | 64.6 | O |
反应后质量/g | O | X | 66.4 | 1.6 |
15.一定条件下,M、N、P、Q四种物质在一密闭容器内充分反应,测得反应前后各物质的质量如表,下列描述中不正确的是( )
A.N物质可能为该反应的催化剂
B.该反应为分解反应
C.该反应中,P、Q两种物质变化的质量比为9:8
D.该反应中,一定有元素化合价改变
16.向AgN03、Cu(N03)2的混合溶液中加入一定量的锌粉,充分反应后过滤,向滤液中滴加稀盐酸有白色沉淀产生。下列说法中,正确的是 ( )
A.所得滤液中可能含有Cu2+ B.所得滤渣中可能含有铜和锌
C.所得滤液中一定含有Ag+、Zn2+、Cu2+D.所得滤渣中一定含有银和铜
17.下列图象不能正确反映其对应关系的是 ( )
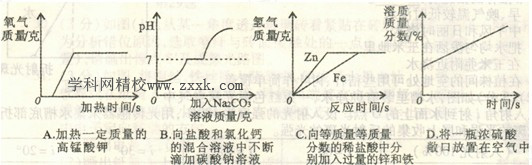
18.下列对部分化学知识的归纳完全正确的一组是 ( )
A
| 化学与 生活 | ①生活中常用加热煮沸的方法将硬水软化 ②用燃烧的方法可区分羊毛和涤纶 |
B
| 化学与 环境 | ①使用化石燃料不会对环境产生影响 ②PM2.5是造成灰霾天气的“元凶"之一 |
C
| 化学与 安全 | ①图书、档案着火,要用水基型灭火器灭火 ②在室内放一盆水,可防止煤气中毒 |
D
| 化学与 健康 | ①人体缺铁会引起贫血 ②用甲醛的水溶液浸泡海产品保鲜 |
第Ⅱ卷(非选择题共84分)
第Ⅱ卷共l7题,29~36题为物理题,37~43题为化学题,44~45题为生物题。
37.(6分)从H、C、N、O、K五种元素中选择适当的元素,按要求用化学用语填空。
(1)两个氢氧根离子 (2)显+3价氮的氧化物
(3)碘酒中的溶剂 (4)一种复合肥料
(5)C60在充足的氧气中燃烧,(5)一种氧化物和一种碱反应
38.(3分)氧气占空气的体积分数约为 ;它的化学性质比较活泼,在生产生活中有着广泛的应用,但有时也会带来危害,需要将氧气隔绝。请你各举一例予以说明:
应用氧气:;隔绝氧气:。
39.(3分)右图是A、B两种固体物质的溶解度随温度变化的曲线图,请回答:
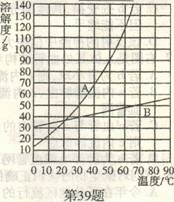
(1)30℃时,A物质的饱和溶液中溶质、溶剂、溶液的质量之比为 。
(2)60℃时,将等质量的A、B物质的饱和溶液分别降温至 0℃,析出晶体的质量AB(填“<"、“="或“>”)。
(3)当A中含有少量B时,通常采用方法提纯A。
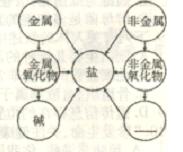
40.(6分)环潭镇中心学校九(6)班同学在学习了酸、碱、盐的化学性质后,有了许多发现:
(1)不同类别的物质间能相互转化。右图是小木同学归纳出
的各类物质间的转化关系。(用“→ "表示)
①请补充转化关系图中的空白处 (填物质类别)
②请从关系图中选择合适的方法,写一个制取AlCl3的化学方程式。
(2)不同类别的物质间能相互反应。下图方框内的六种物质为
Zn、Mg0、H2S04、BaCl2、Ca(OH)2、K2C03.(“——”表示相连物质间在一定条件下能发生化学反应)请帮小昊同学完成填空。
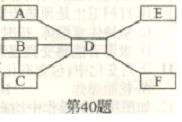
①A常用于改良酸陛土壤,试推断:B为,D为。
②写出B与C反应的化学方程式,该反应属于(填基本反应类型)
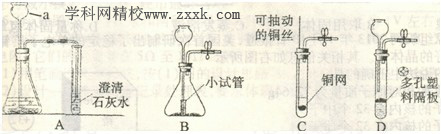
41.(4分)如图A是实验室制取二氧化碳并检验其性质的实验装置图,请你回答:
(1)a仪器的名称为 。
(2)检查A装置气密性的方法是 。
(3)小雪同学按图A方式将导管伸人试管中,溶液未出现浑浊现象,你认为可能的原因是
(答出一条即可)。
(4)为了制取方便,小聪同学设计了如图B、C、D三种改进装置,你认为能起到“随开随制,随关随停”效果的是。 (填序号)
42.(6分)据报道:一辆满载20t电石的挂车,在浙江滨江区江南大道信诚路口燃起熊熊大火。在事故路面上,沿路洒满了五六百米燃着的石头,这辆货车在雨中整整烧了一天,消防官兵对大火也束手无策,场面令人震撼。
长岭中心中学九(1)班化学兴趣小组对上述报道产生浓厚兴趣,为此进行探究,请你一起参入。
【查阅资料】 电石[CaC2]是一种重要的化工原料,遇水即发生剧烈反应并放出大量的热,生成一种可燃气体[C2H2]和一种白色固体。
【提出问题】白色固体是什么物质?
【进行猜想】小明猜想白色固体可能是Ca0、Ca(OH)2、Ca(HC03)2或CaC03中的一种。
(1)你认为小明猜想的依据是 。
(2)小雨上网查阅后得知,白色固体不是Ca(HC03)2,同时提出猜想中的Ca0也不存在,
你认为白色固体不是Ca0的理由是(用化学方程式表示)。
【实验探究】小浩对白色固体讲行探究,请你帮忙完成。
实验方案 | 实验操作 | 实验现象 | 实验结论 |
小浩的方案
| 取少量白色固体于试管中,向其中加入稀盐酸 | 固体溶解, 无气泡冒出 | (3)
|
我的方案 | (4) | (5) | 白色固体是 Ca(OH)2 |
【综合应用】结合上述事例,请你就易燃易爆物在贮存和运输时应注意的事项,提出一条合理建议:(6)。
43.(6分)实验中学化学兴趣小组为了测定某赤铁矿石中Fe203的质量分数,取20克样品放入烧杯中,再取稀盐酸分五次加入烧杯中,每次均充分反应(杂质不溶于水,也不参加反应),测得实验数据如下:
次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
加入稀盐酸的质量(g) | 2l | 21 | 2l | 2l | 21 |
剩余固体的质量(g) | 16 | 12 | 8 | 4 | 4 |
求:
(1)此赤铁矿石中Fe203的质量分数。
(2)恰好完全反应时所得溶液中溶质的质量分数。
随州市2013年初中生毕业升学考试
化学参考答案及评分标准
第1卷(选择题)
题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
答案 | B | A | C | B | D | C | D | A |
(每小题2分,共8个小题,计16分)
第Ⅱ卷(非选择题)
37.(6分)(1)20H-(2)N203(3)C2H50H
(4)KN03(5)C60+6002点燃60C02(6)2KOH+C02=K2C03+H20
(每空l分,共6分)
38.(3分)21%;应用氧气:氧气可以供给呼吸,用于潜水和医疗;支持燃烧,用于焊接和切割金属;液态氧气用作火箭的助燃剂等(任答一条,其他合理答案亦可);隔绝氧气:食物易发生腐烂,食品应采用真空包装;金属器皿易锈蚀,要进行防锈;氧气支持燃烧,灭火时就要使可燃物与氧气隔绝等(任答一条,其他合理答案亦可)。(每空l 分,共3分)
39.(3分)(1)50:100:150(或l:2:3)(2)>
(3)冷却热饱和溶液(或降温结晶)(每空l分,共3分)
40.(6分)(1)①酸②2Al+6HCl=2A1C13+3H2↑(或Al203+6HCl=2A1C13+3H20或Al(OH)3+3 HCl=A1C13+3 H20或2A1+3CuCl2=2A1C13+3Cu等,其他答案合理亦可)
(2)①K2C03H2S04②K2C03+BaCl2=BaCO3↓+2KCl 复分解反应(每空l分,共6分)
4 1.(4分)(1)长颈漏斗(填漏斗不给分)(2)向长颈漏斗中注水至浸没漏斗下端管口,用止水夹夹住胶皮管,继续加水至漏斗中形成一段水柱,液柱不下降,装置气密性良好。 (其他合理答案亦可)(3)石灰水已变质或盐酸的浓度过大,HCl气体随导管进入溶液中与Ca(OH)2发生了反应等(其他合理答案亦可)(4)C(每空l分,共4分)
42.(6分)(1)化学反应前后元素种类不变(2)CaO+H20=Ca(OH)2(3)白色固体不是CaC03(4)取少量白色固体于试管中,加适量水溶解,向其中滴入酚酞试剂(或其他合理答案亦可)(5)固体溶解,溶液变红色(或与操作相应的现象正确亦可)(6)遇水或受阳光照射容易发生燃烧或爆炸的物质,不能存放在露天或高温的地方。或:在搬运易燃易爆物时,要轻拿轻放,不能摔,砸或撞击;或严禁烟火,消防器材要齐备等(其他合理答案亦可)(每空l分,共6分)
43.解:(1)赤铁矿中Fe2 03的质量分数=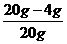 ×100%=80%………………………(2分)
×100%=80%………………………(2分)
(2)据表中数据可知,加入第四次稀盐酸后,样品中的Fe2 03与盐酸恰好完全反应。设此时生成FeCl3的质量为X,则
Fe2 03+6HCl=2FeCl3+3H20
160325
20g-4gX
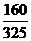 =
=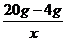 x=32.5g…………………………………………………(2分)
x=32.5g…………………………………………………(2分)
恰好完全反应时所得溶液的溶质质量分数为
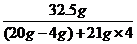 ×100%=
×100%=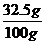 ×l00%=32.5%………………………(2分)
×l00%=32.5%………………………(2分)
答.略(无答案和题设时扣1分)(本题共6分)


