(单词翻译:单击)
第I卷(选择题 共16分)
可能用到的相对原子质量:
N-14 O-16 S-32 Cl-35.5 Na-23 Ag-108
一、选择题(下列各题只有一个正确选项。其中1~4小题各1分,5~10小题各2分,本大题共16分)
1.(2014年山东济宁,1题,1分)物质的性质决定了物质的用途。下列几种常见物质的性质、用途不一致的是
A.氮气性质稳定保护气
B.酒精可燃性 消毒剂
C.食醋酸性 除水垢
D.干冰升华吸热人工降雨
2.(2014年山东济宁,2题,1分)日常生活中的许多做法都蕴含 化学知识的运用。其中,运用不正确的是
化学知识的运用。其中,运用不正确的是
A.低温冷藏有助于减缓食品腐败
B.保鲜膜可保持水果水分、隔离空气,延长保质期
C.烹调绿叶蔬菜焖烂煮透,营养更加丰富
D.食用碱可消除面粉发酵产生的酸味
3.(2014 年山东济宁,3题,1分)“水是生命的源泉”。下面对水化学式(H2O)意义的理解,错误的是
年山东济宁,3题,1分)“水是生命的源泉”。下面对水化学式(H2O)意义的理解,错误的是
A.水是一种氧化物
B.水是由氢、氧两种元素组成的
C.水分子中含有氢、氧两种原子
D.水分子中含有两个氢原子、一个氧原子
4.(2014年山东济宁,4题,1分)对下面一些实验现象的描述,正确的是
A.氢气在空气中点燃 发出黄光、放出热量
B.铁粉在空气中加热 剧烈燃烧、生成黑色固体
C.浓硫酸敞口放置 溶液的颜色、质量不变
D.烧碱固体放入水中 迅速溶解、溶液温度升高
5.(2014年山东济宁,5题,2分)对下面符号或示意图的理解,正确的是
A.Fe2+、Fe3+都属于铁元素,是同一种离子
B.NO2、N2O4中氮元素的化合价都是+4价,是同一化合物
C.NH4NO3中氮元素有两种不同的化合价,分别是-3、+5
D. 两种粒子的电子排布情况相同,属于同一元素
两种粒子的电子排布情况相同,属于同一元素
6.(2014年山东济宁,6题,2分)依据不同化学反应的特点,可将某些反应归于同一类型。下面几组分类结果最合理的一组是
①2CO+O2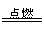 2CO2
2CO2
②CuO+CO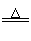 Cu+CO2
Cu+CO2
③Na2O+2HCl=2NaCl+H2O
④Na2O2+2H2O=2NaOH+H2O2
A.①③B.②③C.③④D.②④
7.(2014年山东济宁,7题,2分)右图为硝酸钾和氯化钠两种物质的饱和溶液的质量分数随温度变化的曲线,M、N分别是50℃时硝酸钾和氯化钠质量分数随温度变化曲线上的点。分析曲线得到的以下结论中,正确的是
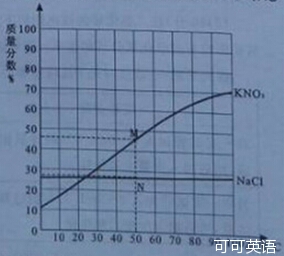
A.50℃时,M、N之间任一点表示的溶液一定是肖酸钾和氯化钠的饱和溶液
B.50℃时,其他条件不变,升温至60℃,M点向右平移,硝酸钾的溶解度增大
C.50℃时,其他条件不变,降温至40℃,N点向右平移,氯化钠的溶解度减小
D.50℃时,向两饱和溶液添加溶质,M点不动,硝酸钾和氯化钠的溶 解度增大
解度增大
8.(2014年山东济宁,8题,2分)某无色气体可能由H2、CH4、CO、CO2中的 几种组成。将些混合气体通过过量的澄清石灰水,出现白色浑浊;将剩余气体导出,经干燥后点燃,罩在火焰上方的干燥烧杯内壁有水珠生成。该混合气体的可能组成是
几种组成。将些混合气体通过过量的澄清石灰水,出现白色浑浊;将剩余气体导出,经干燥后点燃,罩在火焰上方的干燥烧杯内壁有水珠生成。该混合气体的可能组成是
A.H2、CH4
B.H2、CO
C.H2、CH4、CO
D.CH4、CO、CO2
9.(2014年山东济宁,9题,2分)“电子垃圾”中含有金属铜和少量贵金属金、银等,直接废弃将严重污染环境且造成金属资源浪费。社会实践小组为回收这些金属,设计了以下操作步骤:
①分拆、灼烧:把废弃电子产品分拆后灼烧,将部分金属转化为氧化物;
②酸洗:用硝酸溶解灼烧得到的混合物,过滤,收集残渣中的金;
③回收:利用合适的金属提炼出滤液中的铜和银。
为达到分别提炼金属铜、银的目的,下列方案合理的是
A.用金属铁同时提炼出铜和银
B.先用金属铜提炼出银,再用金属铁提炼出铜
C.用金属铁提炼出金属铜
D.用金属铜提炼出金属银
10.(2014年山东济宁,10题,2分)有甲、乙、丙、丁四种无色溶液,它们分别是HCl、H2SO4、BaCl2、Na2CO3溶液中的一种。为区别这四种溶液,现将它们两两混合并得到下面现象:
溶液 | 甲+乙 | 乙+丙 | 丙+丁 | 甲+丁 |
现象 | 无明显现象 | 白色沉淀 | 白色沉淀 | 无色气体 |
根据对上述现象的分析,可推知甲、乙、丙、丁四种溶液的顺序依次是
A.HCl 、BaCl2、H2SO4、Na2CO3
、BaCl2、H2SO4、Na2CO3
B.H2SO4、HCl、BaCl2、Na2CO3
C.HCl、H2SO4、BaCl2、Na2CO3
D.H2SO4、Na2CO3、HCl、BaCl2
第II卷(非选择题 共34分)
二、填空与简答(共17分)
11.(2014年山东济宁,11题,4分)分子、原子和离子都是构成物质的粒子。请按要求用符号完成下面问题(每题答案不唯一,请务必写全)
(1)五氧化二磷分子中的原子 O、P ;
(2)氯化镁中溶液中的离子 Mg2+、Cl- ;
(3)化肥硫酸铵中的原子团 N H4+、SO42-;
H4+、SO42-;
(4)二氧化碳溶液中的分子 H2O、H2CO3 ;
12.(2014年山东济宁,12题,4分)今年5月,吴王夫差剑重返苏州。吴王夫差剑为春秋末期制造的青铜剑,时隔2500年,虽表面有一层蓝色薄锈,但仍寒光逼人,刃锋极锋利,堪称削铁如泥,吹毛断发。
仔细阅读上面文字,完成下面问题:
(1)青铜是金属材料中 合金 ,其主要成分是 Cu、Zn (填符号 );
);
(2)从文中信息可以看出,青铜具有 A、C ;
(3)吴王夫差剑表面的蓝色薄锈,其主要成分为碱式碳酸铜[化学式:Cu2(OH)2CO3],这层蓝色薄锈形成的可能原因是 铜与空气中的氧气、水分、二氧化碳等物质发生反应反应 。
13、(2014年山东济宁,13题,4分)用滤纸折成蝴蝶并喷洒某种溶液或试剂后,悬挂于铁架台上。另取一只盛有某未知溶液的烧杯,放在纸蝴蝶的下方(见右图)。一会儿,纸蝴蝶的颜色发生变化,请回答:
(1)若纸 蝴蝶上喷洒的是酚酞试液,纸蝴蝶变红色,烧杯中的溶液是 浓氨水 ;
蝴蝶上喷洒的是酚酞试液,纸蝴蝶变红色,烧杯中的溶液是 浓氨水 ;
(2)若纸蝴蝶上喷洒的是石蕊试液,纸蝴蝶变红色,烧杯中的溶液是 浓盐酸 ,若纸蝴蝶变蓝色,烧杯中的溶液是 浓氨水 ;
(3)试分析产生以上现象的原因是 浓氨水显碱性、浓盐酸显酸性,它们又都具有挥发性,按发出来的物质能使无色酚酞试液或紫石蕊溶液变色 。
14、(2014年山东济宁,14题,4分)轻质碳酸钙广泛应用于橡胶、塑料、油漆、水性涂料以及造纸等行业,日常生活中的牙膏也常用它作摩擦剂。目前轻质碳酸钙的生产主要是碳化法,工艺流程见下图:
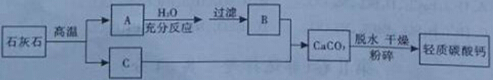
请分析轻质碳酸钙的生产流程,回答下列问题:
(1)物质B的化学式为 Ca(OH)2 ;
(2)在A→B之间,过滤操作的目前是 将Ca(OH)2与水分离 ;
(3)在B +C→CaCO3的过程中,应控制物质C的流量,原因是 CaCO3+CO2+H2O=Ca(HCO3)2 (用化学方程式表示);
+C→CaCO3的过程中,应控制物质C的流量,原因是 CaCO3+CO2+H2O=Ca(HCO3)2 (用化学方程式表示);
(4)生产轻质碳酸钙的方法很多请再设计一种制备方法 Na2CO3+CaCl2=CaCO3↓+2NaCl (用化学方程式表示)。
15.(2014年山东济宁,15题,1分)近年,我国不少城市和地区 雾霾天气增多,雾是水蒸气,本身无污染,“霾”由细小颗粒物组成,主要来源是热电排放、化工生产、汽车尾气、冬季供暖以及地面灰尘等。它侵蚀着人们的健康,严重影响着人们的生活和出行。
雾霾天气增多,雾是水蒸气,本身无污染,“霾”由细小颗粒物组成,主要来源是热电排放、化工生产、汽车尾气、冬季供暖以及地面灰尘等。它侵蚀着人们的健康,严重影响着人们的生活和出行。
下面治理雾霾的措施中,可行的是 ①②④⑥ 。
三、实验与探究(共11分)
16、(1)(2014年山东济宁,16题,6分)实验室可用草酸(H2C2O4)在浓硫酸的作用下分解制得一氧化碳和二氧化碳(化学方程式为:H2C2O4 CO2↑+CO↑+H2O)。用县的实验装置见下图:
CO2↑+CO↑+H2O)。用县的实验装置见下图:

若分别得到一氧化碳和二氧化碳,请回答:
①装置A中,盛放浓硫酸的仪器名称是 分液漏斗 ;
② 收集一氧化碳时,打开a、b,关闭c,装置B的作用是 吸收混合气中的二氧化碳 。由于一氧化碳有毒,多余的气体应 点燃处理(或用气囊收集) (填写具体处理办法);
收集一氧化碳时,打开a、b,关闭c,装置B的作用是 吸收混合气中的二氧化碳 。由于一氧化碳有毒,多余的气体应 点燃处理(或用气囊收集) (填写具体处理办法);
③关闭 b 、打开 c ,释放出二氧化碳,并通过装置 C、D 可收集到干燥的二氧化碳气体。
(2)(2014年山东济宁,16题,5分)在二氧化锰的催化作用下,过氧化氢迅速分解生成氧气和水。哪些因素还影响着过氧化氢分解的速率?课外活动小组结些进行了更深入的探究:
探究实验一:浓度对化学反应速率的影响
实验步骤 | 现 象 | 结 论 |
取一支试管加入3~5mL5%的过氧化氢溶液,然后加入少量二氧化锰。 | 缓慢有少量气泡冒出 | 浓度越大,过氧化氢分解的速率越快 |
另取一支试管加入3~5mL15%的过氧化氢溶液,然后加入少量二氧化锰。 | 迅速有大量气泡冒出 |
请你设计:
实验用品:试管、烧杯、热水、冷水、5%过氧化氢溶液、15%过氧化氢溶液
探究实验二:温度对化学反应速率的影响
实验步骤 | 现 象 | 结 论 |
取一支试管加入3~5mL15%的过氧化氢溶液,然后把试管放入盛有冷水的烧杯中 | 缓慢有少量气泡冒出 | 温度越高,过氧化氢分解的速率越大 |
取一支试管加入3~5mL15%的过氧化氢溶液,然后把试管放入盛有热水的烧杯中 | 迅速有大量气泡冒出 |
四、分析与计算(共6分)
 17.
17. (2014年山东济宁,17题,2分)最近,网上有文章报道:一些厂家为了使生产出来的米线更白净、更筋道,在米线中添加一些名为焦亚硫酸钠(化学式:Na2S7O5)的食品添加剂,若长期食用,对人体危害很大。
(2014年山东济宁,17题,2分)最近,网上有文章报道:一些厂家为了使生产出来的米线更白净、更筋道,在米线中添加一些名为焦亚硫酸钠(化学式:Na2S7O5)的食品添加剂,若长期食用,对人体危害很大。
阅读以上信息后,请回答:
(1)焦亚硫酸钠的化学式量为 350 ;
(2)焦亚 硫酸钠中S、O两种元素的质量比为 14:5 。
硫酸钠中S、O两种元素的质量比为 14:5 。
18.(2014年山东济宁,18题,4分)课外探究小组对实验教师提供的一包白色固体(可能是NaCl、Na2SO4、Na2CO3和NaNO3的一种或几种)进行了下面的实验,且每步实验中均加入足量的试剂,至充分反应。实验过程、现象见下图:

请分析实验过程并完成以下问题:
(1)实验中不能用稀盐酸代替稀硝酸的原因是 防止稀盐酸与AgNO3溶液反应,对判断是否含有NaCl造成干扰;
(2)滴加Ba(NO3)2的目的是 检验白色固体中是否含有Na2SO4 ;
(3)通过计算推断:原白色固体的成分为 NaCl:0.585g 、NaNO3:0.415g 。(简单写出必要的计算过程)。
解:原白色固体中氯化钠的质量为x。
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5
x1.435g
=
x=0.585g
故原白色固体中还含有NaNO3,其质量为:1g-0.585g=0.415g。


