(单词翻译:单击)
第Ⅰ卷(选择题共40分)
一、选择题(本题包括20小题,每小题2分,共40分。每小题只有一个选项符合题意。)
1.元素在自然界里分布不均匀,如智利富藏铜矿、澳大利亚多铁矿、我国山东富含黄金,但从整个地壳中元素的含量来看,最丰富的金属元素是 ( )
A.O B.Si C.Al D.Fe
2.“节能减排、低碳生活”的主题旨在倡导节约能源和利用清洁能源,减少温室气体二氧化碳的排放。下列措施中不符合该主题的是

A.广泛使用太阳能和风能等清洁能源 B.回收利用废旧金属
C.多少用一次性筷子 D.减少使用私家车次数,多乘公交车或骑自行车
3.下列变化属于化学变化的是
A.石油分离出汽油、煤油和柴油等 B.煤焦化产生焦炭、煤焦油、焦炉气等
C.工业上分离空气制取氧气、氮气 D.膜法和热法淡化海水
4.分类是化学学习、研究的重要方法。下列有关物质的分类错误的是
A.水属于氧化物 B.干冰属于单质 C.硝酸铵属于盐 D.乙醇属于有机物
5.下列实验操作错误的是
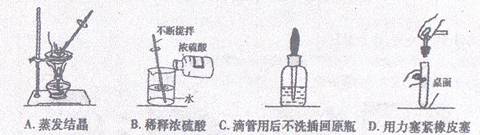
6.下列有关实验现象的描述,正确的是
A.铁丝在氧气中剧烈燃烧,火星四射,生成白色固体
B.分别点燃一小块棉纤维和羊毛纤维,都产生烧焦羽毛的气味
C.测定空气中氧气含量的实验里,铜丝加热变黑
D.一氧化碳高温还原氧化铁时,红色粉末逐渐变为银白色
7.过多的植物营养物质如尿素CO(NH2)2等进入水体恶化水质,导致“水华”现象。尿素属于
A.氮肥 B.磷肥 C.钾肥 D.复合肥
8.今年5月,南京某公司丢失一枚探伤用放射源铱—192,经多方寻找终于放回安全箱。右下图是元素周期表提供的铱元素的部分信息,下列说法正确的是
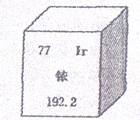
A.铱的原子序数为70 B.铱原子的核电荷数为77
C.铱的相对原子质量为192.2g D.铱属于非金属元素
9.溶洞中存在的化学反应:CaCO3 + CO2 + H2O = Ca(HCO3)2,此反应属于
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
10.实验室中利用过氧化氢、氯酸钾、高锰酸钾都可以制取氧气,其原因是
A.都属于氧化物 B.都含有氧气 C.都含有氧分子 D.都含有氧元素
11.稀土元素铕(Eu)是激光及原子能应用的重要的材料。已知氯化铕的化学式为EuCl3,则氧化铕的化学式为
A.EuO B.Eu2O3 C.Eu3O2 D.EuO3
12.关于分子和原子两种粒子的叙述正确的是
A.物质只能由分子、原子构成 B.分子质量一定大于原子质量
C.化学变化中分子数目一定发生变化 D.同种原子可能构成不同分子
13.据探测卫星发回的数据分析,火星大气中95%是二氧化碳,其余为少量的氮气、氢气,还找到了有液态水存在的证据。根据以上信息。某同学作出如下推断:①火星大气是混合物 ②火星大气与地球大气成分相似 ③火星上钢铁不易生锈 ④火星环境适宜人类生存 ⑤火星上温室效应显著。你认为正确的是
A.①③⑤ B.②③⑤ C.②③④ D.①④⑤
14.化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如136C表示核内有6个质子和7个中子的碳原子。下列关于13153I和12753I的说法错误的是
A.各一个原子相比较,质子数相同 B.各一个原子相比较,中子数相同
C.各一个原子相比较,核外电子数相同 D.属于同种元素
15.关于下列事实的解释不正确的是
选项 | 事实 | 解释 |
A | 10mL酒精和10mL水混合后体积小于20mL | 分子之间有间隔 |
B | 稀硫酸和稀盐酸化学性质相似也存在差异 | 溶液中都含有H+,也存在不同的SO42—、Cl—离子 |
C |
| 化学反应中每个原子都易得1个电子 |
D | 化肥硫酸铵不能和熟石灰混放或混用 | 硫酸铵与熟石灰发生中和反应 |
16.掌握化学用语是学好化学的关键。下列化学用语与所表述的意义相符合的是
①FeCl2—氯化亚铁 ②2Ca2+—2个钙离子 ③O2—2个氧原子 
⑤H2O—1个水分子 ⑥2H—2个氢元素 
A.①④⑤⑦ B.②③④⑥ C.①②⑤⑦ D.②⑤⑥⑦
17.化学兴趣小组的同学利用废铜制取硫酸铜,设计了如下两个方案:

比较上述两个方案,你认为方案一的优点是
①节约能源 ②不产生污染大气的二氧化硫 ③提高硫酸的利用率 ④提高铜的利用率
A.②③ B.①②③ C.①③④ D.①②③④
18.取一滤纸条,等间距10滴紫色石蕊试液,然后装入玻璃管中(如图所示),两端管口同时放入分别蘸有浓氨水和浓盐酸的棉球,几秒后观察到图示现象.下列说法不正确的是( )
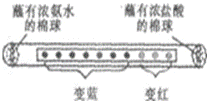
A.氨水的pH大于7,盐酸的pH小于7 
B.浓氨水和浓盐酸都易挥发
C.氨分子和氯化氢分子运动速率都相等
D.酸、碱能使酸碱指示剂显示不同颜色 
19.某化学兴趣小组为验证Ag、Fe、Cu三种金属的活动性顺序,设计了如下图所示的实验操作。其中可以达到实验目的的组合是( )
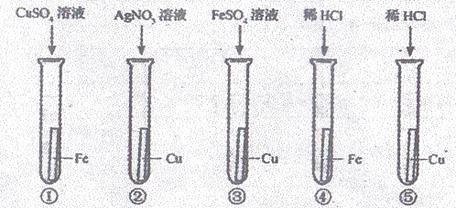
A.①②或②③或②④⑤ B.②④或①③或②④⑤
C.①③或②③或①④⑤ D.①②或②③或③④⑤
20.现有a、b、c、d四种无色溶液,分别是碳酸钾溶液、硫酸溶液、氯化钡溶液、盐酸中的一种。两两混合后出现右图所示的现象,请确定a、b、c、d分别是
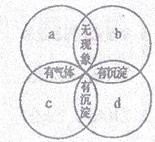
A.硫酸溶液、碳酸钾溶液、氯化钡溶液、盐酸
B.氯化钡溶液、盐酸、碳酸钾溶液、硫酸溶液
C.碳酸钾溶液、硫酸溶液、盐酸、氯化钡溶液
D.盐酸、硫酸溶液、碳酸钾溶液、氯化钡溶液
第Ⅱ卷(非选择题 共60分)
二、(本题包括6小题,共26分)
21.(5分)从化学的视角认识厨房中蕴含的丰富化学知识。
(1)下列食物中富含蛋白质的是_____________(填字母序号,下同);

(2)下列厨房用品所使用的主要材料,属于金属材料的是 ____________;

(3)天然气是主要的家用燃气。天然气的主要成分是 ____________ ;
(4)炒菜时油锅着火,盖上锅盖即可灭火,原因是____________;
(5)洗涤剂可清洗餐具上的油污,这是因为洗涤剂具有____________功能。
22.(3分)2014年4月2日~4日发生了清华学生PX词条“保卫战”,最终在百度百科上锁定 “PX”为“低毒化合物”的准确描述,向国人揭示了尊重事实的科学态度。PX是“对二甲苯,其组成和结构如右图所示,相关性质如下:
“PX”为“低毒化合物”的准确描述,向国人揭示了尊重事实的科学态度。PX是“对二甲苯,其组成和结构如右图所示,相关性质如下:
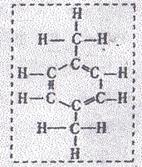
①无色透明液体,有芳香气味 ②熔点13.2℃、沸点138.5℃
③密度0.86g/cm3 ④ 可燃 ⑤有挥发性,但比汽油低 ⑥遇火可爆炸,但爆炸性比汽油低 ⑦低毒,毒性与汽油相当
(1)上表中属于PX物理性质的是(填性质代号)____________;
(2)试写出PX在空气中完全燃烧反应的化学方程式____________;
(3)根据PX的性质,从防止环境污染和安全的角度,应如何保存和储运PX  ;
;
23.(5分)KNO3和NaCl在不同温度时的溶解度如下表所示。请回答下列问题:
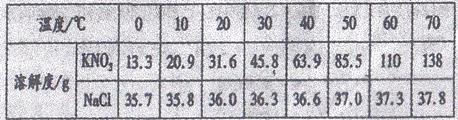
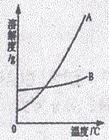
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如右图所示:图中能表示KNO3溶解度曲线的是____________(填“A”或“B”)
(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解度,则温度的范围是____________;
(3)某兴趣小组做了一下实验:
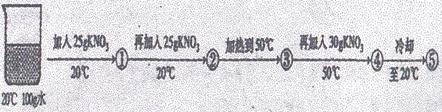
上述实验过程中得到的溶液一定属于不饱和溶液的是____________(填数字序号),将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体____________g;
(4)硝酸钾中含有少量氯化钠时,可通过____________填“蒸发结晶”或“降温结晶”)的方法提纯。
24.(4分)“微观—宏观—符号”三重表征是化学独特的表示物质及其变化的方法。请结合图示完成下列问题:
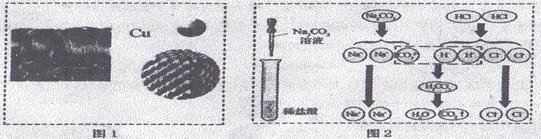
(1 )图1中,“Ca”表示多种信息,如表示铜元素、金属铜单质,还能表示____________;
)图1中,“Ca”表示多种信息,如表示铜元素、金属铜单质,还能表示____________;
(2)从微粒的角度说明图2反应的实质是____________;
(3)为减少温室气体排放,人们积极寻找不含碳元素的燃料。经研究发现NH3燃烧的产物没有污染,且释放大量能量,有一定应用前景。其反应的微观示意图如图3所示:
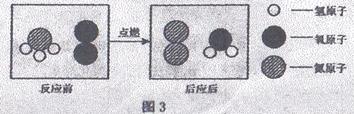
该反应的化学方程式为________________,其基本反应类型属于________________。
25.(5分)右图所示A~G是初中化学常见的物质。图中“→”表示转化关系,“—”表示相互能反应。已知A是人体胃液中含有的酸,G是最轻的气体,B和C含有相同的元素。
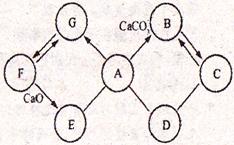
(1)写出F的化学式________________,E物质的一种用途________________,C物质的一条化学性质________________;
(2)C和D反应需要高温,写出它们反应的化学方程式 ________________;
(3)A→B反应的化学方程式是________________。
26.(4分)海洋是人类宝贵的自然资源,海水“制碱”体现了化学科学在改造物质中的智慧。下图是某厂生产纯碱的工艺流程图:
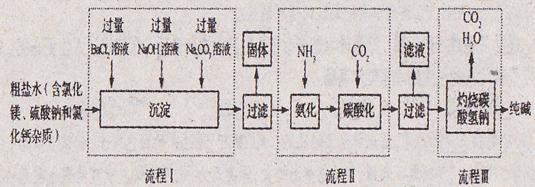
请完成下列问题:
(1)该厂最终产品有___________________(填物质名称);
(2)流程Ⅰ中为了除去杂质,加入过量BaCl2溶液、NaOH溶液和Na2CO3溶液,下列说法正确的是___________________(填字母序号)
A.加入三种物质的顺序不能调整
B.加入三种溶液将粗盐水中的SO42-、Mg2+、Ca2+转化为沉淀
C.按流程Ⅰ所加溶液的顺序除杂,过滤后得4种沉淀
(3)在流程Ⅱ中,如果加入氨气不是为了生产氯化铵,氨气在制碱过程中的作用是______________;
(4)写出Ⅲ中发生反应的化学方程式___________________ 。
27.(7分)化学实验是科学探究的重要途径。请根据下列实验图示回答相关问题:
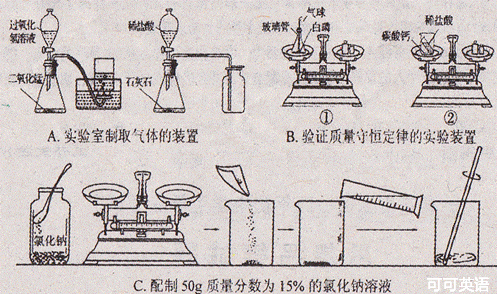
(1)A是实验室制备气体的发生于收集装置。用过氧化氢溶液与二氧化锰制取氧气的化学方程式为___________________,制取氧气、二氧化碳可用同样的发生装置,原因是___________________,选择收集装置的依据是___________________;
(2)B实验中设计合理的是___________________(填“①”或“②”),另一装置设计中存在的问题
是___________________;
(3)C是定量实验,选择仪器不恰当或操作不规范都会导致实验结果有误差。实验时选择量筒规格应为___________________(填“50mL”或“100mL”),称量时砝码与药品放反了(1g以下为游码),所得溶液的质量分数___________________15%(填“小于”、“等于”或“大于”)。
28.(15分)实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题】该样品中含有那些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。
则NaOH变质反应的化学方程式为___________________
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和碳酸氢钠溶液中几乎不溶解。
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
实验操作 | 实验现象 | 实验结论 |
(1)取少量样品溶于水,加入 | 白色沉淀产生 | 该反应的化学方程 式: ; |
(2)将上述反应后的混合物过滤,取滤液加入 。 | 。 | 证明猜想Ⅱ正确 |
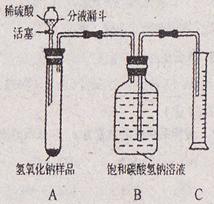
【提出问题2】如何测量该部分变质样品中碳酸钠的质量分数?
【实验探究 2】小红同学设计如右下图所示装置(铁架台略去),实验在27℃,101kPa下进行,步骤如下:
2】小红同学设计如右下图所示装置(铁架台略去),实验在27℃,101kPa下进行,步骤如下:
①按图连接好装置;
②用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和碳酸氢钠溶液220mL。
请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是___________________ ;
(2)B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由是___________________ ;
(3)试管中原有的空气对实验结果是否有明显影响?___________________(填“有”或“没有”)
(4)变质氢氧化钠样品中碳酸钠的质量分数为___________________。(在27℃,101kPa时二氧化碳的密度为1.8g/L)(计算结果精确至1%)
【提出问题3】怎样提纯该样品得到纯净的氢氧化钠固体?
【实验探究3】为得到纯净的氢氧化钠固体,小亮设计了如下图所示的实验流程。
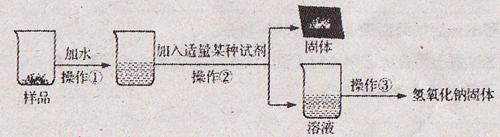
请回答下列问题:
(1)操作①、②、③的名称分别为___________________,为了使样品充分溶解,操作①中还要用到的玻璃仪器是___________________;
(2)该实验中发生反应的化学方程式为 ___________________;
(3)最终所得氢氧化钠固体质量 ___________________变质后样品中氢氧化钠的质量( 填“小于
填“小于 ”、“等于”或“大于”)。
”、“等于”或“大于”)。
【实验反思】
(1)通过本题,你学会了定性检验氢氧化钠的变质、定 量测定变质样品中某成分的含量,以及除杂提纯物质。为了得到可靠的实验结果,探究过程中你需要思考的问题有___________________(填数字序号);
量测定变质样品中某成分的含量,以及除杂提纯物质。为了得到可靠的实验结果,探究过程中你需要思考的问题有___________________(填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地 ④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差
(2)实验探究Ⅰ中的检验和实验探究3中的除杂都将碳酸钠进行了转化,但二者目的不同,分别是___________________ 。
四、(本题包括2小题,共12分)
29.(5分)钙是维持人体正常功能所必须的元素,有时需要服用补钙满足人体需求。下图分别为两种补钙剂说明书的一部分。

请根据图示中的信息回答下列问题:
(1)钙是人体必须的常量元素,每日要摄取足量的钙,才能避免___________________(填字母序号);
A.佝偻病或骨质疏松 B.贫血症 C.甲状腺肿大
(2)葡萄糖酸钙(C12H22O14Ca)的化学式量是 ___________________;
(3)碳酸钙(化学式为CaCO3)中钙元素的质量分数为 ___________________;
(4)每片金钙尔奇中含碳酸钙的质量为___________________mg;
(5)按照金钙尔奇说明书每日的补钙量,若该服用葡萄糖酸钙片,一日3次,一次应服用几片?________________。
30.(7分)兴趣小组的同学为测定某一铁铜合金中含铁的质量分数,将6g该合金粉末样品,加入溶质质量分数为10%的硫酸铜溶液160g中,二者恰好完全反应。同时为了充分利用资源,还对反应后的物质进行回收处理。请结合下列图示计算:
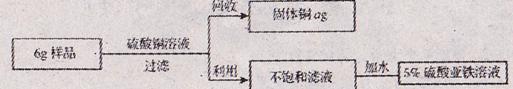
(1)该合金样品中含铁的质量分数;(计算结果精确至0.1%)
(2)所的固体铜的质量a为多少g?
(3)向不饱和滤液中加入多少g水,能得到5%的硫酸亚铁溶液,用于花卉的营养液。
((2)(3)中计算结果精确至0.1g)




 ;
;
