(单词翻译:单击)
试卷真题
第Ⅰ卷 选择卷
一、选择题(本大题共10题,每题3分,共30分。每题的四个选项中,
 只有一个选项符合题意)
只有一个选项符合题意)
1.下列过程只涉及物理变化的是
A.酒精挥发 B.蜡烛燃烧 C.食物腐败 D.食醋除水垢
2.氧化铟锡是触摸屏技术重要材料,它由氧化锡和氧化铟熔融而成。氧化铟(Y2O3)中,铟元素(Y)的化合价为
A.0 B.+2 C.+3 D.+6
3.下列有关物质应用的叙述,错误的是
A.用日用洗涤剂去除油污 B.用碳酸钠做面点发酵粉
C.用石油炼制汽油与煤油 D.用甲醛溶液泡制海产品
4.近期我国部分地区发生洪涝灾害,饮用水源受到污染。为保证居民正常生活,必须对饮用水源净化处理。若用下述方法处理饮用水源:①消毒②自然沉降③过滤,处理先后顺序是
A.②③① B.②①③ C.③②① D.③①②
5.维生素C(C6H8O6)是人体不可缺少的营养物质。下列说法错误的是
A.维生素C不属于氧化物 B.维生素C 中碳、氧元素质量比为1∶1
C.维生素C能增强人体抗病能力 D.新鲜水果和蔬菜中富含维生素C
6.O2、H2O和CO2都是身边常见的物质。下列说法正确的是
A.O2能支持燃烧,可用作燃料
B.H2O由氢分子和氧原子构成
C.可用带火星的木条鉴别O2和CO2
D.CO2是光合作用的原料,空气中含量越高 越好
越好
7.下列事实与对应的解释不相符的是
A.墙内开花墙外香――分子不断运动
B.水烧开后,壶盖被顶开――分子体积变大
C.甘蔗甜,柠檬酸――不同分子性质不同
D.物质热胀冷缩――微粒间的间隙变化
8.Mg(OH)2分解需吸收热量,生成耐高温的MgO和水蒸气。利用这一性质,可将Mg(OH)2添加到易燃性材料中做阻燃剂。关于Mg(OH)2能起阻燃作用的叙述,错误的是
A.Mg(OH)2分解要吸热,降低了可燃物的着火点
B.Mg(OH)2分解能够降温,使可燃物不易达到着火点
C.Mg(OH)2分解生成的MgO覆盖在可燃物表面,隔绝了空气
D.Mg(OH)2分解生成大量水蒸气,降低可燃物周围氧气的浓度
9.“接龙”是化学扑克(和普通扑克相似,牌面标注物质的化学式)的一种游戏,其规则是:当上家出牌时,下家跟出的牌所标注的物质必须能与上家的反应。某局游戏中,甲到戊五人各有一张不同的牌,牌面标注“CuSO4”、“H2SO4”、“NaOH”、“Fe”、“Fe2O3”。若甲的牌为“Fe2O3”,且按甲-乙-丙-丁-戊依次出牌时能满足“接龙”规则,则丁的牌是
a.NaOH B.Fe C.H2SO4 D.CuSO4
10.右图为硫酸钠和氯化钠的溶解度曲线。下列说法正确的是
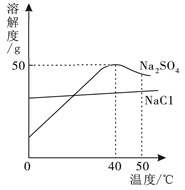
A.温度升高,两种物质的溶解度都增大
B.50℃的Na2SO4饱和溶液降到40℃时有晶体析出
C.40℃时,75g饱和Na2SO4溶液中含25g Na2SO4
D.可用降温结晶的方法提纯含少量Na2SO4的NaCl
第Ⅱ卷 非选择卷
二、非选择题(本大题共8题,共70分)
11.(6分)右图是燃气热水器示意图。
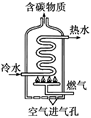
(1)某热水器以天然气(主要成分是CH4)为燃气。
①写出CH 4完全燃烧的化学方程式:
4完全燃烧的化学方程式:
_______________________________________;
②当“空气进气孔”被部分堵塞,燃烧将产生有毒气体 M。M的化学式为_______。
(2)1kg不同燃料燃烧产生CO2和SO2的质量如右表。
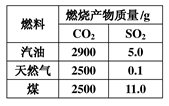
①最不会污染环境的 燃料是______________;
燃料是______________;
②燃烧时最会促成酸雨的燃料是______________。
12.(7分)化学是在原子、分子水平上研究物质及其变化的科学。
(1)现有下列化学式或微粒符号:①2CO、②Ca2+、③2H、④O2。其中,“2”表示2个分子的是__________(填序号,下同),表示每个微粒带2个单位电荷的是_______。
(2)一定条件下,甲和乙反应生成丙和丁(四种物质均由分子构成),反应前后微观示意图如右。下列说法正确的是____________(填选项)。
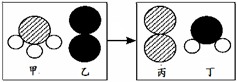
A.反应前后共有4种原子
B.该反应有单质生成
C.反应前后元素化合价都不变
D.化学变化中分子和原子均可再分
E.该化学反应中,甲、丁两种分子的个数比是2∶3
(3)胃酸过多须服用抗酸药。下表为两种抗酸药的有效成分及其构成微粒:
抗胃酸药 | 复方氢氧化镁片剂 | 铝碳酸镁片 |
有效成分 | Mg(OH)2 | AlMg(OH)3CO3 |
构成微粒 | M | Al3+、Mg2+ |
由于抗酸药有效成分不同,起抗酸作用(即消耗胃液中盐酸)的微粒也有差异。
①Mg(OH)2起抗酸作用的微粒是___________(填微粒符号,下同)。
②铝碳酸镁与盐酸的反应为:AlMg(OH)3CO3+5HCl=MgCl2+AlCl3+4H2O+CO2↑。则铝碳酸镁起抗酸作用的两种微粒是___________ 、 ___________。
13.(6分)二氯异氰脲酸钠(C3O3N3Cl2Na)是一种预防H7N9禽流感的有效消毒剂。右图为某工厂生产的二氯异氰脲酸钠产品的标签。

(1)1%的二氯异氰脲酸钠溶液呈_________性(填“酸”或“碱”)。
(2)25℃时,饱和二氯异氰脲酸钠溶液的溶质质量分数为______。
(3)已知:C3O3N3Cl2Na相对分子质量为220。请计算分析,标签中“有效氯(Cl%)≥60%”是否为C3O3N3Cl2Na中氯元素的质量分数。计算过程(列出计算式即可):________________________________。
结论:“有效氯(Cl%)”________(填“是”或“不是”)指C3O3N3Cl2Na中氯元素质量分数。
14.(11分)铁是生产、生活中应用广泛的金属材料。
(1)酸菜等酸性的食物不宜用铁质器具长期盛放,因为______________。
(2)为减缓海水对铁质海轮外壳的腐蚀,制造海轮时,会在海轮船底四周镶嵌比铁更活泼的金属。下列金属适宜船底镶嵌的是________(填选项)。
A.Pb(铅)  B.Cu C.Pt(铂) D.Zn
B.Cu C.Pt(铂) D.Zn
(3)对铁“发蓝”处理,其表面将形成致密氧化膜而有效避免腐蚀。
①致密氧化膜能有效阻止铁锈蚀的原因是___________________。
②“发蓝”过程的化学方程式如下,式中X的化学式为_________。
36Fe + 4NaNO2 + 9NaNO3 + 26H2O = 12X + 13NaOH + 13NH3↑
③为检验“发蓝”处理的铁质零件表面是否形成致密氧化膜,将该零件浸泡于硫酸铜溶液中,发现零件表面出现红色物质。由此可知该零件“发蓝”处理效果______(填“好”或“不好”),因为_________ ________________(用化学方程式表示)。
________________(用化学方程式表示)。
15.(8分)据报道:我省某渔船在霞浦海域捕鱼时,船上4名进入船舱的船员突然中毒倒地。医生介绍,船员中毒是因为吸入鱼虾高度腐烂产生的、高浓度的硫化氢(H2S)。已知,硫化氢是一种无色、剧毒、可燃性气体。
(1)鱼虾腐烂会产生硫化氢,与鱼虾富含_________有关(填选项)。
A.糖类 B.维生素 C.蛋白质
(2)实验室常用湿润的硝酸铅试纸检验H2S。已知硝酸铅[Pb(NO3)2]与H2S发生复分解反应,该反应的化学方程式为____________。
(3)有同学建议,将燃着的蜡烛带入船舱,观察舱内气体是否燃烧,可确定船舱内H2S浓度是否较高。这一做法非常危险,因为____________。
(4)若有渔民向你请教,如何避免进入堆放鱼虾的密封船舱因吸入高浓度的H2S而中毒。你的一条建议是 ____________。
____________。
16.(10分)右图装置用于制取某些气体。
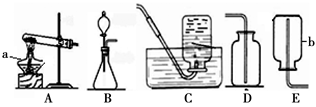
(1)填写下列仪器的名称:
a:________________;
b:________________。
(2)若用KMnO4制取氧气,反应的化学方程式为________________,应选择的发生装置是________________(填序号),不能选用的收集装置是______(填序号)。
(3)虽然常温常压下乙烯(C2H4)不与空气反应,但因密度很接近空气而不用排空气法收集。若用排空气法收集乙烯,将________________ ; 排水法收集乙烯时,
排水法收集乙烯时, 待导气管口连续稳定地冒出气泡才开始收集,原因是_________________________。
待导气管口连续稳定地冒出气泡才开始收集,原因是_________________________。
17.(12分)小李在化学实验技能考查中,完成“用稀盐酸鉴别氢氧化钠溶液和碳酸钠溶液,并测碳酸钠溶液的pH”实验。
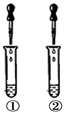
【实验一】小李取待测液甲、乙分别放置在试管①和②,再往两支试管中
滴入稀盐酸,观察实验现象。根据现象推知,乙为碳酸钠溶液。
(1)实验中,小李应观察到试管②的现象是__________________________________,该试管中反应的化学方程式为_________________________________。
(2)老师指出:除盐酸外,还可使用其它试剂鉴别氢氧化钠和碳酸钠溶液。请你选择一种不属于酸的试剂,并将鉴别实验中的预期现象以及化学方程式填入下表。
选择的试剂 | 预期现象 | 反应的化学方程式 |
____________ | 一支试管无明显现象; 另一支试管________________ | _________________________ |
【实验二】小李用玻璃棒蘸取“实验一”后试管②中的溶液沾在pH试纸上,观察试纸颜色变化并与标准比色卡对照,读出溶液的pH。小李的记录如下:
实验现象 | 结论 |
溶液沾在试纸上时,试纸缓慢地变色 | 与标准比色卡对比,Na2CO3溶液pH=3 |
(3)小李因操作错误,得出“Na2CO3溶液pH=3”的错误结论。指出小李操作错误之处答:_______________________________________________________________。
(4)指出小李记录的“实验现象”中不科学的地方。
答:_______________________________________________。
18.(10分)尿素[CO(NH2)2]溶液可用作柴油汽车尾气处理液。
(1)若在实验室配制尿素溶液,需要用到的玻璃仪器有胶头滴管、烧杯、_________和_____________。
(2)右图为某公司生产的车用尿素溶液的标签,用尿素溶液处理柴油汽车尾气(含NO)时的化学方程式如下(反应条件略去):2CO(NH2)2 + 4NO + O2 = 2CO2+ 4N2 + 4H2O。

现有一瓶未开启的该车用尿素溶液:
①所含尿素的质量是_______________;
②若用该瓶溶液处理汽车尾气,可吸收NO的质量是多少?
(相对分子质量:CO(NH2)2 60;NO 30)
试题答案
2014年龙岩市初中毕业、升学考试
参考答案及评分标准
化 学
总说明:
1.考生若写出其它正确答案,可参照评分标准给分。
2.化学方程式中,化学式写错的不给分,化学式对而未配平的扣0.5分.
3.化学专用名词中出现错别字、元素符号有错误的均不给分。
4.凡试题中未特别指明某物质是写名称还是化学式,正确写出其一即可给分。
一、选择题(本大题共10题,每题3分,共计30分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | A | C | D | A | B | C | B | A | D | C |
二、非选择题(本大题共8题,共70分)
11.(6分)
(1)①CH4+2O2 CO2+2H2O…………………………………………(2分)
CO2+2H2O…………………………………………(2分)
②CO……………………………………………………………………(2分)
(2)①天然气…………………………………………………………………(1分)
②煤……………………………………………………………………(1分)
12. (7分)
(1)① ②…………………………(每空1分,共2分。多选或错选不得分)
(2)BE…………………………………(各1分,共2分。多选或错选不得分)
(3)①OH-……………………………………………………………………(1分)
②OH-、CO32-…………………………………………(每空1分,共2分)
13. (6分)
(1)酸………………………………………………………………………(1分)
(2)20 %……………………………………………………………………(2分)
(3)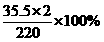 …………………………(2分。其他合理答案参照给分)
…………………………(2分。其他合理答案参照给分)
不是…………………………………………………………………(1分)
14. (11分)
(1)铁会与酸反应而使铁质器具被腐蚀…………………(2分。其他合理答案参照给分)
(2)D…………………………………………………………………………(2分)
(3)①致密的氧化膜使铁与氧气(或空气)和水隔绝
………………………………………(2分。只答氧气或水给1分)
②Fe3O4 ………………………………………………………………(2分)
③不好…………………………………………………………………(1分)
Fe+CuSO4=Cu+FeSO4………………………………………………(2分)
15. (8分)
(1)C………………………………………………………………………(2分)
(2)Pb(NO3)2+H2S=PbS↓+2HNO3…………………………………………(2分)
(3)H2S气体与氧气(或空气)的混合物点燃时易发生爆炸
…………………………(2分。其他合理答案参照给分)
(4)打开舱门通风……………………………(2分。其他合理答案参照给分)
16 . (10分)
. (10分)
(1)酒精灯 集气瓶……………………………………(每空1分,共2分)
(2)2KMnO4 K2MnO4+MnO2+ O2↑……………………………………(2分)
K2MnO4+MnO2+ O2↑……………………………………(2分)
A E……………………………………………………(每空1分,共2分)
(3)不易排尽瓶内空气,导致收集到的气体不纯………(2分。其他合理答案参照给分)
以免收集到的气体因混有空气而不纯………………(2分。其他合理答案参照给分)
17. (12分)
(1)有气泡冒出………………………………………………………………(2分)
Na2CO3+2HCl=2NaCl+H2O+CO2↑……………………………………(2分)
(2)
选择的试剂 | 预期现象 | 反应的化学方程式 |
Ca(OH)2溶液 | 产生白色沉淀(出现白色浑浊) | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH |
…………(现象1分,试剂及方程式各2分,共5分。其他合理答案参照 给分)
给分)
(3)小李所取溶液为盐酸与碳酸钠反应后的溶液………(2分。其他合理答案参照给分)
(4)试纸立即变色而非缓慢地变色………………………………………(1分)
18. (10分)
(1)玻璃棒 量筒…………………………………………(每空1分,共2分)
(2)①3.25kg…………………………………………………………………(2分)
②解:设可吸收NO的质量为x
2CO(NH2)2+4NO+O2=2CO2+4N2+4H2O
120 120
3.25kg x ……………………………………(2分)
120:120=3.25kg:x ………………………(2分)
x=3.25kg ………………………(2分)
答:可吸收NO的质量为3.25kg。

 g2+、OH—
g2+、OH— 、OH-、CO32-
、OH-、CO32-
