(单词翻译:单击)
一、选择题
1.下列叙述中,前者是化学变化,后者利用物理性质的是()
A.石蜡融化 氧气用于炼钢 B.纸张燃烧 氮气用于食品包装
C.铁生锈 铜用于制电线 D.干冰升华 小苏打用于焙制糕点
解析:A、石蜡融化过程中没有生成新物质,属于物理变化;氧气用于炼钢是利用了氧气的化学性质﹣﹣氧化性;
B、纸张燃烧生成水和二氧化碳,属于化学变化; 氮气用于食品包装是利用了氮气的化学性质﹣﹣不活泼;
C、铁生锈的过程中生成了新物质﹣﹣铁锈,属于化学变化; 铜用于制电线是利用了铜的物理性质﹣﹣良好的导电性;
D、干冰升华过程中,二氧化碳由固体变成气体,没有生成新物质,属于物理变化;小苏打用于焙制糕点是利用了小苏打的化学性质﹣﹣受热易分解.
故选C
2.下列各组物质中,前者是纯净物,后者是混合物的是()
A.氢氧化钠 稀盐酸 B.碘酒 红磷
C.空气 氧气 D.海水 石灰石
解析:A、氢氧化钠属于纯净物,稀盐酸中含有氯化氢和水,属于混合物,故A正确;
B、碘酒是碘溶解到酒精中,属于混合物,红磷由一种物质组成,属于纯净物,故B错;
C、空气中含有氧气、氮气、二氧化碳等物质,属于混合物,氧气由一种物质组成,属于纯净物,故C错;
D、海水中含有水、氯化钠、氯化镁等物质,属于混合物;石灰石主要成分是碳酸钙,属于混合物,故D错.
故选A
3.规范的实验操作是实验成功的关键.下列实验操作错误的是()
A. |
过滤 | B. |
溶解 | C. |
取固体药品 | D. |
蒸发 |
解析:A、过滤实验中滤纸紧贴漏斗的内壁;滤纸的边缘要低于漏斗的边缘,漏斗内液体的液面低于滤纸的边缘;倾倒液体时,烧杯嘴紧靠引流的玻璃棒,玻璃棒末端紧靠在三层滤纸处,漏斗下端紧靠接受的烧杯.故A操作正确;
B、溶解时为加快溶解的速度,要用玻璃棒不断搅拌,故B操作正确;
C、为防止药品被污染,取用药品时,瓶塞要倒放,故C操作错误;
D、蒸发溶液时,用玻璃棒不断地进行搅拌,图中操作正确,故D操作正确;
故选C
4.下列实验现象的描述中,正确的是()
A.细铁丝在氧气中燃烧,火星四射,生成黑色固体四氧化三铁
B.将铝丝插入硫酸铜溶液中,溶液由蓝色变为浅绿色
C.将氢氧化钠溶液滴入氯化铁溶液中,有红褐色沉淀产生
D.将二氧化碳通入紫色石蕊溶液中,溶液 变为蓝色
变为蓝色
解析:A、细铁丝在氧气中燃烧,火星四射,但生成黑色固体四氧化三铁是实验结论而不是实验现象,故选项说法错误.
B、铝的金属活动性比铜强,能与硫酸铜溶液反应生成硫酸铝溶液和铜,将铝丝插入硫酸铜溶液中,溶液由蓝色变为无色,故选项说法错误.
C、氢氧化钠溶液与氯化铁溶液反应生成氢氧化铁红褐色沉淀,将氢氧化钠溶液滴入氯化铁溶液中,有红褐色沉淀产生,故选项说法正确.
D、二氧化碳与水反应生成碳酸,碳酸能使石蕊溶液变红色;将二氧化碳通入紫色石蕊溶液中,溶液变红色,故选项说法错误.
故选C
5.中央电视台播出的《舌尖上的中国》很受观众欢迎,该节目介绍中国的美食及制作方法.“群众利益无小事,食品安全是大事”,“饮食健康”是人们普遍的生活追求.下列做法正确的是()
A.食用“加铁酱油”,可以补充铁元素,预防缺铁性贫血
B.用甲醛溶液浸泡海产品,以防其腐烂
C.用地沟油炸制油条
D.在火腿肠中添加工业用盐亚硝酸钠,使其保持肉质鲜美
解析:A、人体缺铁会引起缺铁性贫血;故A正确;
B、由于甲醛能和蛋白质反应,使蛋白质分解,破坏蛋白质的结构,使其变质;故B错误;
C、地沟油含有毒素,流向江河会造成水体营养化 ,一旦食用,则会破坏白血球和消化道黏膜,引起食物中毒,甚至致癌;故C错误;
,一旦食用,则会破坏白血球和消化道黏膜,引起食物中毒,甚至致癌;故C错误;
D、亚硝酸钠与肉、鱼等食品中的胺类发生反应,形成有强致癌作用的亚硝基化合物;故D错误;
故答案为A
6.氢气中氢元素的化合价为()
A.+1B.0C.﹣2D.﹣1
解析:根据单质中元素的化合价为0,氢气属于单质,故氢元素的化合价为0.
故选B
7.下列对宏观现象的微观解释不正确的是()
A.CO与CO2化学性质不同,是因为它们的分子构成不同
B.NaOH溶液与KOH溶液都能使酚酞溶液变成红色,是因为它们的溶液中都含有OH﹣
C.金刚石和石墨物理性质存在差异,是因为它们的原子排列方式不同
D.温度计受热时,水银柱上升,是因为汞原子受热时体积变大
解析:A、CO与CO2化学性质不同,是因为它们的分子构成不同,不同种的分子性质不同,故选项解释正确.
B、NaOH溶液与KOH溶液都能使酚酞溶液变成红色,是因为它们的溶液中都含有OH﹣,故选 项解释正确.
项解释正确.
C、金刚石和石墨物理性质存在差异,是因为它们的原子排列方式不同,故选项解释正确.
D、温度计受热时,水银柱上升,是因为汞原子间的间隔受热时变大,故选项解释错误.
故选D
8.下列化学方程式书写正确的是()
A.2Fe+6HCl═2FeCl3+3H2↑B.CO+Fe2O3 2Fe+CO2
2Fe+CO2
C.C+CO2 2COD.2NaOH+CuSO4═Na2SO4+Cu(OH)2
2COD.2NaOH+CuSO4═Na2SO4+Cu(OH)2
解析:A、铁和盐酸反应生成氯化亚铁和氢气,正确的化学方程式为:Fe+2HCl═FeCl2+H2↑.
B、该化学方程式配平错误,正确的化学方程式应为3CO+Fe2O3 2Fe+3CO2.
2Fe+3CO2.
C、该化学方程式书写完全正确.
D、该化学方程式氢氧化铜后面没有标注↓,正确的化学方程式应为2NaOH+CuSO4═Na2SO4+Cu(OH)2↓.
故选C
9.木糖醇(C5H12O5)具有较好的防龋齿特性.下列关于木糖醇的说法正确的是()
A.木糖醇中含有22个原子
B.木糖醇由碳、氢、氧三种元素组成
C.木糖醇中碳、氢、氧元素的质量比为5:12:5
D.木糖醇中碳元素的质量分数最大
解析:A.木糖醇C5H12O5是由木糖醇分子构成的,1个木糖醇分子是由5个碳原子、12个氢原子和5个氧原子构成,共22个原子,故错误;
B.木糖醇C5H12O5是由碳、氢、氧三种元素组成的,故正确;
C.木糖醇中碳、氢、氧三种元素的质量比为(12×5):(1×12):(16×5)=15:3:20,故错误;
D.在木糖醇C5H12O5中,碳元素的质量为:12 ×5=60,氢元素的质量为:1×12=12,氧元素的质量为:16×5=80,则木糖醇中氧元素的质量分数最大,故错误.
×5=60,氢元素的质量为:1×12=12,氧元素的质量为:16×5=80,则木糖醇中氧元素的质量分数最大,故错误.
故选B
10.为验证甲、乙、丙三种金属的活动性顺序,把三种金属分别放入稀盐酸中,只有乙表面无明显变化,把甲放入丙的硝酸盐溶液中,甲的表 面有丙析出,则甲、乙、丙三种金属的活动性顺序由强到弱的是()
面有丙析出,则甲、乙、丙三种金属的活动性顺序由强到弱的是()
A.甲>乙>丙B.乙>甲>丙C.甲>丙>乙D.丙>乙>甲
解析:由于三种金属只有金属乙不可以和盐酸反应生成气体,说明金属乙的化学性质最不活泼;把甲投入到丙的硝酸盐溶液中,在甲表面有丙析出,说明甲的金属活动性比丙强,故三种金属的活动性强弱关系是甲>丙>乙.
故选C
11.下列出去杂质的方法中正确的是()
选项 | 物质 | 杂质 | 除杂质的方法 |
A | CaCl2溶液 | 稀盐酸 | 加过量碳酸钙,过滤 |
B | K2CO3溶液 | KCl | 加适量稀盐酸 |
C | CaO | CaCO3 | 加水,过滤 |
D | NaCl溶液 | Na2CO3 | 加适量硝酸钙溶液,过滤 |
A.A B.B C.C D.D
解析:A、稀盐酸能与过量碳酸钙反应生成氯化钙、水和二氧化碳,再过滤除去过量的不溶于水的碳酸钙,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
B、K2CO3溶液能与稀盐酸反应生成氯化钾、水和二氧化碳,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
C、CaO能与水反应生成氢氧化钙,碳酸钙难溶于水,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
D、Na2CO3能与适量硝酸钙溶液反应生成碳酸钙沉淀和硝酸钠,能除去杂质但引入了新的杂质硝酸钠,不符合除杂原则,故选项所采取的方法错误.
故选A
12.下列实验过程与图象描述不相符合的选项是()
A.
一定温度下,向饱和氢氧化钙溶液中加入氧化钙
B.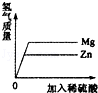
向等质量的镁、锌中同时加入 稀盐酸
稀盐酸
C.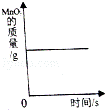
加热一定量的氯酸钾和二氧化锰混合物制氧气
D.
一定量的石灰石加入到足量的稀盐酸中(不考虑水的蒸发、氯化氢的挥发)
解析:A、因为氧化钙与水饱和的氢氧化钙溶液中的水反应放出大量的热,导致氢氧化钙的溶解度变小,会析出溶质,溶质的质量变小;故错误;
B、反应相等质量的硫酸产生相等质量的氢气;相等质量的金属镁、锌完全反应时镁生成氢气多,故正确;
C、催化剂是在化学反应中能改变其它物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有改变的物质.故正确;
D、碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,溶液增加的质量为碳酸钙的质量,减少的是二氧化碳的质量,溶液的质量逐渐增加,反应停止后不变,而氢元素的质量不变,所以溶液中氢元素的质量分数先减小后不变,故正确.
故选A
13.现有一包由铁粉、木炭粉、镁粉组成的固体混合物5g,向其中加入一定溶质质量分数的稀盐酸100g,充分反应后过滤,得到滤液103.8g、滤渣1g,下列说法中正确的是()
A.生成氢气的质量是0.2g
B.滤液中一定含有氯化镁、氯化亚铁和盐酸
C.稀盐酸的溶质质量分数大于或等于7.3%
D.若滤渣的成分是木炭粉,则混合物中铁、镁的质量比为1:1
解析:A、铁粉、镁粉可以与稀盐酸反应并释放出氢气,木炭粉不与稀盐酸反应.生成氢气的质量为:5g+100g﹣103.8g﹣1g=0.2g,故正确;
B、若铁粉、镁粉恰好与稀盐酸反应,滤液中只含有氯化镁、氯化亚铁,故错误;
C、当铁粉、镁粉恰好与稀盐酸反应时,稀盐酸的质量分数最小,设稀盐酸的溶质质量为x.
由铁粉、镁粉与稀盐酸反应方程式 Fe+2HCl=FeCl2+H2↑、Mg+2HCl=MgCl2+H2↑可得关系式2HCl~H2
73 2
x 0.2g
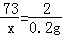
x=7.3g
此时稀盐酸的溶质质量分数为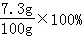 =7.3%所以,稀盐酸的溶质质量分数大于或等于7.3%正确;
=7.3%所以,稀盐酸的溶质质量分数大于或等于7.3%正确;
D、设两种金属的混合平均分子质量为y.
由铁粉、镁粉与稀盐酸反应方程式 Fe+2HCl=FeCl2+H2↑、Mg +2HCl=MgCl2+H2↑可得金属关系式M~H2
+2HCl=MgCl2+H2↑可得金属关系式M~H2
y 2
4 0.2g
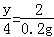
y=40=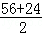 ,故正确;
,故正确;
故选:ACD
二、填空题(共10小题,每空1分,共30分)
14.用适当的数字和化学用语填空:
(1)空气中含量最多的物质_________;
(2)两个铝原子_________;
(3)由60个碳原子构成的单质分子_________;
(4)天然气的主要成分_________.
解析:(1)空气中含量最多的物质是氮气,其化学式为:N2.
(2)原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.所以2个铝原子,就可表示为:2Al;
(3)根据固态的非金属元素由原子构成的物质,它的元素符号表示这种物质,碳元素组成的单质是单原子分子,因此由60个碳原子构成的单质分子表示为:C60;
(4)天然气的主要成分是甲烷,其化学式为:CH4.
故答案为:(1)N2(2)2Al(3)C60(4)CH4
15.化学与生活密切相关,化学使我们的生活更加美好:
(1)PM2.5是指大气中直接小于或等于2.5微米的颗粒物.我国正加大对PM2.5污染物的检测力度.
①大雾天气导致呼吸道病人增多,因为雾霾可使空气中增加大量的_________.
A、二氧化氮 B、二氧化硫 C、一氧化碳 D、可吸入颗粒物
②PM2.5口罩中使用了活性炭,这是利用了活性炭的_________作用.
(2)生活中硬水软化的常用方法是_________.
(3)缺乏某种维生素会使人患病,某病人患有夜盲症,是因为缺乏_________.
(4)请从“A、二氧化碳、B、稀盐酸、C、大理石、D、氖气”中,选择适当的物质填空:常用做建筑材料的是_________;能促进植物光合作用的是_________;通电时能发出有色光的是_________(填字母).
解析:(1)PM2.5是首要污染物,PM2.5是指大气中直径小于或等于2.5微米的颗粒物,雾霾可使空气中增加大量的可吸入颗粒物;PM2.5口罩中使用了活性炭,这是利用了活性炭的吸附作用;故答案为:D;吸附
(2)生活中硬水软化的常用方法是煮沸,实验室中常用的是蒸馏;故答案为:煮沸
(3)缺乏维生素A会使人患夜盲症,故答案为:维生素A
(4)大理石、石灰石是常用的建筑材料,二氧化碳能促进植物的光合作用,通电时能发出有色光的是稀有气体,氖气属于稀有气体,故答案为:C;A;D;
16.如图是甲、乙、丙三种固体物质的溶解度曲线,请回答:
(1)t2℃时,甲、乙、丙三种物质的溶解度由小到大的顺序是_________.
(2)P点的含义是_________.
(3)若将甲物质的不饱和溶液变为饱和溶液,下列说法正确的是_________
A、溶剂的质量一定变小 B、溶质的质量可能不变
C、溶质的质量分数一定变大 D、溶液的质量变大
(4)将t2℃时,甲、乙、丙三种物质的饱和溶液,都降温至t1℃时,所得溶液的溶质质量分数由大到小的顺序是_________.
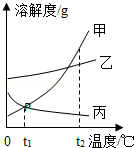
解析:(1)t2℃时,甲、乙、丙三种物质的溶解度由小到大的顺序是丙<乙<甲;
(2)P点是t1℃时,甲丙的溶解度曲线的交点,表示该温度下两物质的溶解度相等;
(3)甲的溶解度随温度升高而增大,若将甲物质的不饱和溶液变为饱和溶液,可采取加入溶质、蒸发溶剂、降温的方法;
A、若采取降温和加入溶质的方法,则溶剂的质量不变,故错误;
B、若采取蒸发溶剂、降温的方法,溶质的质量不变,若采取加入溶质的方法,溶质的质量增加,所以溶质的质量可能不变,正确;
C、若采取降温至恰好饱和的方法,溶质的质量分数不变,故错误;
D、若采取降温至恰好饱和的方法,溶液的质量不变,故错误;
(4)甲、乙的溶解度随温度升高而增大,丙的溶解度随温度升高而减小,所以将t2℃时,甲、乙、丙三种物质的饱和溶液,都降温至t1℃时,甲、乙析出晶体,溶质的质量分数减小,丙溶解度增大,溶质的质量分数与降温前相等,饱和溶液中溶质的质量分数= ×100%,即溶解度越大质量分数也就越大,而t1℃时乙的溶解度大于甲的溶解度大于t2℃时丙的溶解度,故所得溶液的溶质质量分数由大到小的顺序是乙>甲>丙;
×100%,即溶解度越大质量分数也就越大,而t1℃时乙的溶解度大于甲的溶解度大于t2℃时丙的溶解度,故所得溶液的溶质质量分数由大到小的顺序是乙>甲>丙;
故答案为:(1)丙<乙<甲;(2)t1℃时,甲丙的溶解度相等;(3)B;(4)乙>甲>丙
17.通过学习我们知道,可以增强作物抗寒、抗旱能力的是_________肥;铵态氮肥不能与碱性物质混合施用,其原因是_________.
解析:磷肥能使农作物根系发达、耐寒耐旱,铵态氮肥与碱性物质混合施用生成氨气,降低肥效,所以铵态氮肥不能与碱性物质混合施用.
故答案为:磷;铵态氮肥与碱性物质混合施用生成氨气,降低肥效.
18.如表是小华甲2014年5月自来水缴费通知单的部分内容:
收费项目 | 单位(元/立方米) | 应收金额(元) |
自来水水费 | 1.70 | 15.30 |
水资源费 | 1.26 | 11.34 |
污水处理费 | 1.04 | 9.36 |
合计金额 | / | 36.00 |
(1)收费项目中包含了水资源费和污水处理费的主要目的是_________.
(2)污水排放标准中明确要求,污水的pH应在6﹣9之间.某工厂排放的污水的pH=5,显_________性(填“酸”“碱”或“中”).如果利用中和反应,使该污水达到排放标准,可在污水中加入_________.
解析:(1)收费项目中包含了水资源费和污水处理费的主要目的是节约用水和保护水资源;
(2)某工厂排放的污水的pH=5,显酸性.可加入碱性物质进行中和,所以要使该污水达到排放标准,可在污水中加入熟石灰.
故答案为:
(1)节约用水和保护水资源;
(2)酸性;熟石灰.
19.目前,我国的一些地区正在使用乙醇汽油作为汽车燃料,使用乙醇汽油可以减少氮的氧化物的排放,是因为乙醇中不含有_________元素.乙醇在空气中燃烧的化学方程式为_________.
解析:乙醇的化学式为C2H5OH,其中只含有碳、氢、氧元素,不含氮元素,完全燃烧只生成二氧化碳和水.燃烧的化学方程式为:C2H5OH+3O2 2CO2+3H2O.故填:氮;C2H5OH+3O2
2CO2+3H2O.故填:氮;C2H5OH+3O2 2CO2+3H2O.
2CO2+3H2O.
能源与环境是人们关注的热点,也是考查的热点,使用乙醇汽油不但可以节省石油资源、有效地减少汽车尾气的污染,还可以促进农业生产.
20.金属的应用非常广泛.
(1)生活中常用的铁锅炒菜,主要是利用了铁的_________.
A、导电性 B、导热性 C、延展性 D、有金属光泽
(2)目前世界上已有50%以上的废钢铁得到回收利用,其目的是_________.
A、节约金属资源 B、合理开采矿物 C、防止钢铁生锈.
解析:
(1)金属的性质在生活中有很多的应用,生活中常用铁锅炒菜,是利用了铁具有良好的导热性,故答案为:B;
(2)目前废钢铁的回收利用率较高,从而大大节约了金属资源,故答案为:A;
21.如图表示的是电解水反应的微观示意图,回答下列问题:
(1)写出反应的化学方程式_________;属于_________反应.(填基本反应类型)
(2)该反应说明了,在化学反应中,分子可以分成原子,_________不能再分.
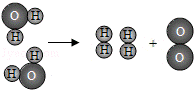
解析:
(1)根据属于装置图结合微观示意图可知是水在通电的条件下产生氢气和氧气,反应的化学方程式为::(1)2H2O 2H2↑+O2↑;是由一种物质生成两种或两种以上物质的反应,属于分解反应;
2H2↑+O2↑;是由一种物质生成两种或两种以上物质的反应,属于分解反应;
(2)化学变化的实质体现了破坏旧分子形成新分子的过程,就是原子重新组合得到新分子的过程;在化学反应中,分子可以分成原子,原子不能再分.
答案:
(1)2H2O 2H2↑+O2↑;分解反应
2H2↑+O2↑;分解反应
(2)原子
22.有一气体混合物含有二氧化碳、一氧化碳、氮气和水蒸气四种气体,现进行如下操作,请回答:(假设每步反应都进行完全)
(1)依次通过NaOH溶液、浓硫酸,此过程中发生反应的化学方程式为_________;
(2)依次通过浓硫酸、炽热的氧化铁粉末,最后得到的气体有_________(填化学式)
解析:
(1)有一气体混合物含有二氧化碳、一氧化碳、氮气和水蒸气四种气体,通过NaOH溶液,二氧化碳会与NaOH溶液反应生成碳酸钠和水,CO2被吸收;再通过浓硫酸除去水蒸气;此过程中发生反应的化学方程式为CO2+2NaOH═Na2CO3+H2O.
(2)浓硫酸具有吸水性,通过浓硫酸,能除去水蒸气;通过炽热的氧化铁粉末,一氧化碳与氧化铁反应生成铁和二氧化碳,一氧化碳被吸收;最后剩余的气体为N2、CO2.
故答案为:(1)CO2+2NaOH═Na2CO3+H2O;(2)N2、CO2.
23.一定量铜粉和锌粉组成的混合物与足量稀盐酸充分反应,过滤,将滤渣在空气中充分加热,加热后所得产物的质量恰好等于原混合物的质量,则元混合物中铜的质量分数为_________.
解析:
一定量的Cu粉和Zn粉的混合物,与足量盐酸充分反应后,由于铜不与盐酸反应所以过滤的得到的固体是铜,加热后固体变成氧化铜,因为加热后产物的质量恰好等于原混合物的质量 ,所以与铜结合的氧的质量就等于锌的质量,则原混合物中铜粉的质量分数等于氧化铜中铜元素的质量分数,即:
,所以与铜结合的氧的质量就等于锌的质量,则原混合物中铜粉的质量分数等于氧化铜中铜元素的质量分数,即: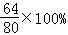 =80%;
=80%;
答案;80%.
三、实验与探究(共3小题,每空1分,共22分)
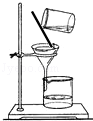
24.请根据下列装置,回答有关问题: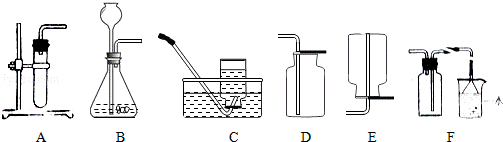
(1)实验室若用B装置制取氧气,长颈漏斗中应加入_________,反应的化学方程式为_________.B装置还可以制取_________气体,从反应物的状态和反应条件角度说明制取该气体的理由是_________.
(2)C装置的收集方法为_________.
(3)经查资料可知,NH3的密度比空气小,极易溶于水,有刺激性气味,实验室常用加热氯化铵和氢氧化钙固体的方法来制取NH3,若用A装置做制取氨气的发生装置,应如何改动_________.最好用_________装置来收集NH3,理由是_________.
解析:(1)实验室若用B装置制取氧气,长颈漏斗中应加入过氧化氢溶液,反应的化学方程式为:2H2O2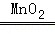 2H2O+O2↑;
2H2O+O2↑;
B装置还可以制取二氧化碳气体,从反应物的状态和反应条件角度说明制取该气体的理由是反应物是液体和固体,不需要加热.
故填:过氧化氢溶液;2H2O2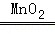 2H2O+O2↑;二氧化碳;反应物是液体和固体,不需要加热.
2H2O+O2↑;二氧化碳;反应物是液体和固体,不需要加热.
(2)C装置的收集方法为排水集气法.
故填:排水集气法.
(3)因为利用氯化铵和氢氧化钙固体制取氨气时需要加热,所以试管口应该略向下倾斜,并且应该用酒精灯加热;
氨气极易溶于水,不能用排水法收集,密度比空气小,可以用向下排空气法收集,即用E装置收集.
故填:试管口略向下倾斜,利用酒精灯加热;E;氨气的密度比空气小,不和空气中的物质反应.
25.现有一包固体粉末,可能是碳酸钠、硫酸钠、硫酸铜、氯化钠中的一种或几种,为了测定其组成,取适量样品进行下列实验,请根据实验现象判断:
(1)取样品溶于水,得到无色澄清溶液,则此固体粉末中一定没有_________.
(2)取上述溶液适量,滴加过量的氯化钡溶液,出现白色沉淀.过滤,向沉淀中加入过量的稀硝酸,沉淀部分消失并产生气泡,则此固体粉末中一 定含有_________.
定含有_________.
(3)取步骤哦(2)试验后的滤液,加入稀硝酸化后,再加入硝酸银溶液,出现白色沉淀.由此某同学得出此固体粉末中一定含有氯化钠.你认为此结论是否正确?_________(填“是”或“否”).请说明理由_________.
解析:题中所给的 各种物质都溶于水,硫酸铜在溶液中显蓝色,碳酸根离子和钡离子会生成碳酸钡沉淀,碳酸钡沉淀会溶于酸生成二氧化碳气体,硫酸根离子和钡离子会生成硫酸钡沉淀,硫酸钡沉淀不溶于酸,氯离子和银离子会生成不溶于酸的氯化银沉淀.
各种物质都溶于水,硫酸铜在溶液中显蓝色,碳酸根离子和钡离子会生成碳酸钡沉淀,碳酸钡沉淀会溶于酸生成二氧化碳气体,硫酸根离子和钡离子会生成硫酸钡沉淀,硫酸钡沉淀不溶于酸,氯离子和银离子会生成不溶于酸的氯化银沉淀.
(1)取样品溶于水,得到无色澄清溶液,则此固体粉末中一定没有:硫酸铜;
(2)取上述溶液适量,滴加过量的氯化钡溶液,出现白色沉淀,过滤,向沉淀中加入过量的稀硝酸,沉淀部分消失并产生气泡,所以此固体粉末中一定含有:硫酸钠、碳酸钠;
(3)取步骤(2)试验后的滤液,加入稀硝酸化后,再加入硝酸银溶液,出现白色沉淀,只能判断是氯离子和银离子生成的氯化银沉淀,但是氯化钡也会提供氯离子,氯化钠也会提供氯离子,所以不能判断固体粉末中一定含有氯化钠,理由是:在步骤(2)中加入的氯化钡,也会引入氯离子,不能氯离子时氯化钠提供的,还是氯化钡提供的.
故答案为:(1)硫酸铜;
(2)硫酸钠、碳酸钠;
(3 )否,在步骤(2)中加入的氯化钡,也会引入氯离子,不能确定氯离子是氯化钠提供的,还是氯化钡提供的.
)否,在步骤(2)中加入的氯化钡,也会引入氯离子,不能确定氯离子是氯化钠提供的,还是氯化钡提供的.
26.牙膏摩擦剂的类型很多,如CaCO3,SiO2或它们的混合物.某兴趣小组对牙膏摩擦剂的成分进行了如下探究.
【提出问题1】某品牌牙膏中是否含有CaCO3?
【查阅资料】二氧化硅不与稀盐酸反应.
【实验方案】
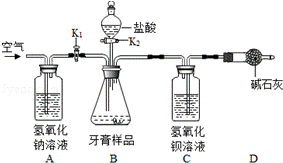
①取少量牙膏于试管中,加入适量的稀盐酸,出现气泡,将气体通入澄清石灰水,石灰水变浑浊,证明摩擦剂中含有_________(填离子符号)
②取实验①中的溶液,加入碳酸钾溶液,生成白色沉淀,请写出该反应的化学方程式_________.
【提出问题2】该牙膏中CaCO3的质量分数是多少?
【实验装置】
【实验步骤】
(1)按如图连接好装置后,发现一处明显的错误,改正为_________;
(2)重新连接好装置,并_________;
(3)在B装置中加入牙膏样品8.00g;
(4)_________K1,_________K2(填“打开”或“关闭”),向牙膏样品中滴入10%的盐酸,至B中无气泡产生时,停止滴加盐酸;
(5)_________,至C中不再产生沉淀;
(6)将C装置中的固液混合物过滤、洗涤、烘干后称量其质量.实验数据如图(已知此品牌牙膏中的其他成分不和盐酸反应,装置内试剂均足量.)
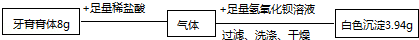
【实验分析及数据处理】
(1)若没有A装置,则测定结果将_________.(填“偏大”、“偏小”或“不变”)
(2)D装置的作用是_________.
(3)据上面数据,计算该牙膏样品中碳酸钙的质量分数是_________.
解析:
【实验方案】①取少量牙膏于试管中,加入过量稀盐酸,出现气泡,将气体通入澄清石灰水中,石灰水变浑浊,说明生成二氧化碳,从而证明摩擦剂中含有碳酸根离子;
②实验①中的溶液中含有氯离子,加入碳酸钾溶液,生成白色沉淀﹣碳酸钙,说明该溶液中含有钙离子,反应的化学方程式是K2CO3+CaCl2=CaCO3↓+2KCl;
【实验步骤】(1)C的作用是吸收反应生成的二氧化碳,装置中导管应长进短出;
(2)实验前应检查装置的气密性,防止装置漏气;
(4)关闭K1,打开K2,向牙膏样品中滴入10%的盐酸,至不再生成气体,停止滴加盐酸;
(5)再次打开K1,关闭K2,缓缓通入一段时间空气,使生成的二氧化碳全部排出,充分反应,至C中不再产生沉淀;
【实验分析及数据处理】
(1)A装置的作用是吸收空气中的二氧化碳,若没有该装置,则进入C的气体还有空气中的二氧化碳,使测量结果偏大;
(2)D装置的作用是吸收空气中的二氧化碳,防止空气中二氧化碳进入,使测量结果不准确;
(3)依据所测生成沉淀数据,计算反应的二氧化碳的质量,并进而计算牙膏中碳酸钙的质量,计算过程如下;
解:根据数据得生成沉淀为3.94g,设参加反应的二氧化碳的质量为x Ba(OH)2+CO2═BaCO3↓+H2O
44 197
x 3.94g
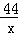 =
=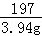
x=0.88g
设碳酸钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
y 0.88g
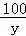 =
=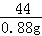
y=2.00g
该牙膏样品中碳酸钙的质量分数是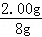 ×100%=25%.
×100%=25%.
故答案为:
【实验方案】①CO32﹣;②K2CO3+CaCl2=CaCO3↓+2KCl;
【实验步骤】(1)C中导管应“长进短出”;
(2)检查装置的气密性;
(4)关闭;打开;B中不再产生气泡;
(5)关闭K2,打开K1,缓缓通入空气;
【实验分析及数据处理】
(1)偏大;(2)吸收空气中的二氧化碳干扰,防止干扰实验测定;
(3)25%
四、理解与应用(本题共2小题,27题4分,28题7分,共11分)
27.如表是某研究小组探究影响反应速率部分因素的相关实验数据.
实验 序号 | H2O2溶液 浓度/% | H2O2溶液 体积/ml | 温度/℃ | MnO2的 用量/g | 收集氧气 的体积/ml | 反应所需 的时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 2 | 49.21 | |
④ | 30 | 5 | 55 | 2 | 10.76 |
(1)通过实验_________和实验_________对比可知(填实验序号),化学反应速率与反应物的浓度有关;从实验③和④对比可知,化学反应速率与_________有关.
(2)用一定量的质量分数为15%的过氧化氢溶液制氧气,在不影响产生氧气质量的前提下,为了减慢反应速率,可采取的措施是_________.
解析:(1)从表中分析可知:①②是过氧化氢浓度不同而其他的反应时各种量均相同,可知这一过程是考查反应物的浓度与反应速度的关系;③④则是温度 不同其他条件相同,明显是对温度影响化学反应速度的探究;故填:①;②;温度;
不同其他条件相同,明显是对温度影响化学反应速度的探究;故填:①;②;温度;
(2)从表中分析可知:①②是过氧化氢浓度不同而其他的反应时各种量均相同,可知这一过程是考查反应物的浓度与反应速度的关系,且反应物的浓度越大,化学反应速率越快,所以用一定量的质量分数为15%的过氧化氢溶液制氧气,在不影响产生氧气质量的前提下,为了减慢反应速率,可采取的措施是加水稀释.故填:加水稀释
28.请分析如表中的信息,回答下列问题:
名称 | 符号 | 原子结构示意图 | 单质化学式 | 常温常压下状态 | 单质与氢气反应 |
氟 | F | _________ | F2 | 气态 | 黑暗处爆炸 |
氯 | Cl |
| Cl2 | _________ | 光照爆炸 |
溴 | Br |
| Br2 | 液态 | 加热反应 |
碘 | I |
| _________ | 固态 | 持续加热 缓慢反应 |
(1)请把如表中的空格补充完整.
(2)①试归纳氟、氯、溴、碘的原子结构规律_________(答一点即可)
②已知非金属单质的活动性与金属的活动性相似,试归纳氟、氯、溴、碘对应单质的活动性变化规律._________(答一点即可)
(3)已知:Cl2和Br2的化学性质相似,Cl2+H2O═HCl+HClO,其中HClO也是一种酸,它与氢氧化钠溶液反应的化学方程式为:HClO+NaOH═NaClO+H2O,分别写出Br2与水,Br2与NaOH溶液反应的化学方程式:_________,_________.
解析:
(1)找出规律:根据原子结构示意图,找出氟原子的结构示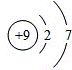 ;根据单质化学式的书写,写出碘的化学式I2;根据常温常压下状态的规律,写出氯的状态为气态;
;根据单质化学式的书写,写出碘的化学式I2;根据常温常压下状态的规律,写出氯的状态为气态;
(2)根据上表总结规律,归纳氟、氯、溴、碘的原子结构规律:
①氟、氯、溴、碘原子的最外层电子数相同或氟、氯、溴、碘原子的电子层数逐渐递增;
②归纳氟、氯、溴、碘对应单质的性质变化规律(单质与氢气的反应剧烈程度):氟、氯、溴、碘单质的化学性质逐渐减弱;
(3)先把Cl2+H2O=HC l+HClO,又因为HCl+NaOH=NaCl+H2O,其中HClO也是一种酸,它与氢氧化钠溶液反应的方程式为:HClO+NaOH=NaClO+H2O,故Cl2与NaOH溶液反应的化学方程式:Cl2+2NaOH=NaClO+NaCl+H2O;则利用知识迁移的方法:可以书写Br2与水,Br2与NaOH溶液反应的化学方程式为:Br2+H2O=HBr+HBrO,Br2+2NaOH=NaBrO+NaBr+H2O.
l+HClO,又因为HCl+NaOH=NaCl+H2O,其中HClO也是一种酸,它与氢氧化钠溶液反应的方程式为:HClO+NaOH=NaClO+H2O,故Cl2与NaOH溶液反应的化学方程式:Cl2+2NaOH=NaClO+NaCl+H2O;则利用知识迁移的方法:可以书写Br2与水,Br2与NaOH溶液反应的化学方程式为:Br2+H2O=HBr+HBrO,Br2+2NaOH=NaBrO+NaBr+H2O.
答案:
(1)
名称符号原子结构示意图单质化学式常温常压下状态 单质与氢气反应
氟F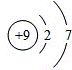 F2气态黑暗处爆炸 氯Cl
F2气态黑暗处爆炸 氯Cl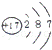 Cl2气态光照爆炸 溴Br
Cl2气态光照爆炸 溴Br Br2液态加热反应
Br2液态加热反应
碘I I2固态持续加热
I2固态持续加热
缓慢反应
(2)
①氟、氯、溴、碘原子的电子层数逐渐递增.
②氟、氯、溴、碘单质的化学性质逐渐减弱
(3)Br2+H2O=HBr+HBrO,Br2+2NaOH=NaBrO+NaBr+H2O
五、计算题(本题共2小题,29题4分,30题7分,共11分)
29.在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,仍有4g氯化钠固体未溶解.请填写下列空白:
(1)所得溶液是20℃时氯化钠的_________溶液(填“饱和”或“不饱和”);此时该溶液的质量为_________g
(2)现欲配制200g质量分数为10%的氯化钠溶液,需氯化钠固体_________g,水_________mL,(水的密度是1.0g/cm3)
解析:(1)在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,仍有4g氯化钠固体未溶解,则所得溶液是20℃时氯化钠的饱和溶液;此时该溶液的质量为40g+100g﹣4g=136g;
(2)氯化钠溶液中氯化钠是溶质,水是溶剂,所需要氯化钠的质量=溶液的质量×溶质的质量分数200g×10%=20g,
需水的质量=200g﹣20g=180g;水的体积为:180g×1.0g/cm3=180cm3=180ml.
答案:
(1)饱和 136
(2)20 180
30.(7分)(2014•绥化)某氢氧化钠样品中含有少量的碳酸钠杂质.现取21.3g样品于烧杯中,加入173.4g水使其完全溶解,再向其中逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示,请计算:
(1)样品中氢氧化钠的质量.
(2)B点时,烧杯内溶液的溶质质量分数.
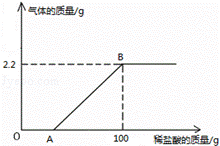
解析:(1)设样品中含有碳酸钠杂质的质量是X,碳酸钠与盐酸反应生成氯化钠的质量为y,Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
X y 2.2g
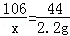 ,
,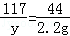
x=5.3g y=5.85g;
样品中氢氧化钠的质量:21.3g﹣5.3g=16g;
(2)B点是盐酸与氢氧化钠以及碳酸钠恰好完全反应,溶液中的溶质只有氯化钠;设,氢氧化钠与盐酸反应生成的氯化钠的质量为z,
NaOH+HCl═NaCl+H2O
40 58.5
16g z
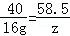
z=23.4g
B点时,烧杯内溶液的溶质质量分数: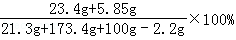 =10%,
=10%,
答:(1)样品中氢氧化钠的质量16g;
(2)B点时,烧杯内溶液的溶质质量分数10%.