(单词翻译:单击)
一、选择题
1.下列物质的用途主要由化学性质决定的是()
A.稀盐酸用于金属表面的除锈 B.在实验室中常用浓硫酸做干燥剂
C.铜丝用于生产电线 D.金刚石用来裁玻璃、切割大理石
解析:A、稀盐酸用于金属表面的除锈,是利用盐酸与铁锈反应,将其除掉,故A由化学性质决定;
B、浓硫酸做干燥剂是利用浓硫酸的吸水性,没有新物质生成,由物理性质决定,故B错;
C、铜丝用于生产电线是利用铜的导电性,利用了物理性质,故C错;
D、金刚石用来裁玻璃、切割大理石利用了金刚石的硬度大,利用了物理性质,故D错.
故选A
2.下列物质的化学式、俗名与分类均不正确的是()
A.NaCO3、纯碱、碱 B.CaO、生石灰、氧化物
C.O2、臭氧、单质 D.NaHCO3、苏打、盐
解析:A.纯碱是碳酸钠的俗称,其化学式为:Na2CO3,是由金属离子和酸根离子构成的化合物,属于盐,故错误;
B.氧化钙俗称生石灰,其化学式为:CaO,属于氧化物,故正确;
C.臭氧的化学式为:O3,属于单质,故错误;
D.苏打是碳酸钠的俗称,碳酸氢钠俗称小苏打,是由金属离子、氢离子和碳酸根离子构成的化合物,属于盐,故错误.
故选B
3.下列关于实验操作的描述错误的是()
A.制取气体时应先检查装置的气密性,然后再装入药品
B.过滤时,将玻璃棒斜靠在三层滤纸的一边
C.在“粗盐中难溶性杂质的去除”实验中,蒸发时将蒸发皿中的溶液直接蒸干
D.制取氧气停止加热时,应先把导气管移出水面,然后再熄灭酒精灯
解析:A、制取气体前一定要先检查装置的气密性,防止装置漏气,故A正确;
B、过滤液体时,要注意一贴二低三靠的原则,其中三靠就是将玻璃棒斜靠在三层滤纸的一边,故B正确;
C、蒸发结晶时,不能将溶液直接蒸干,应等到有大量晶体析出时即停止加热,用蒸发皿的余热蒸干,故C错误;
D、制取氧气停止加热时,应先把导气管移出水面,然后再熄灭酒精灯,否则会出现水倒吸入试管内,使试管炸裂,故D正确
故选C
4.化学与生活密切相关,根据你所学化学知识和生活经验判断,下列说法正确的是()
A.胃酸过多可服用氢氧化钠溶液进行中和
B.吸烟对人体健康没有影响,因为燃着的香烟产生的烟气中不含对人体有害的物质
C.高楼室内起火应立即打开门窗通风,再用湿毛巾捂住口鼻,蹲下靠近地面或沿着墙壁跑离着火区域
D.葡萄糖能为人体组织提供营养,可用葡萄糖溶液为病人补充血糖
解析:A、氢氧化钠具有极强的腐蚀性,不能用于改良酸性土壤,故A错误;
B、香烟燃烧产生的烟气中含有许多有害物质,其中对人体危害最大的是尼古丁(化学式为ClOH14N2)、焦油和一氧化碳等.故B错误;
C、室内起火时,不应立即打开门窗,否则空气流通,火势更旺,故C错误;
D、葡萄糖是人体的六大营养素,能为人体组织提供营养,可用葡萄糖溶液为病人补充血糖,故正确;
故选D
5.下列实验方案中不合理的是()
A.热固性塑料和热塑性塑料﹣﹣加热,观察外形变化
B.为检验CaO中是否含有Ca(OH)2,可将其加水后滴加酚酞溶液
C.用稀H2SO4区别NaOH、K2CO3、BaCl2三种白色固体
D.用熟石灰区别化肥硝酸钾和硝酸铵
解析:A、热塑性的物质受热要熔化,而热固性的物质在受热时不易熔化,所以可用加热,观察外形变化的方法区别热固性塑料和热塑性塑料,故A正确;
B、氧化钙和水反应会生成氢氧化钙,所以不能用加水后滴加酚酞溶液的方法检验CaO中是否含有Ca(OH)2,故B错误;
C、硫酸和氢氧化钠溶液反应生成硫酸钠和水,没有明显的现象 ;硫酸和碳酸钾反应生成硫酸钾、水和二氧化碳气体;硫酸和氯化钡溶液反应会生成硫酸钡白色沉淀和盐酸,所以可用硫酸区别NaOH、K2CO3、BaCl2三种白色固体,故C正确;
;硫酸和碳酸钾反应生成硫酸钾、水和二氧化碳气体;硫酸和氯化钡溶液反应会生成硫酸钡白色沉淀和盐酸,所以可用硫酸区别NaOH、K2CO3、BaCl2三种白色固体,故C正确;
D、熟石灰和硝酸铵反应会放出有刺激性气味的氨气,所以可用熟石灰区别化肥硝酸钾和硝酸铵,故D正确.
故选B
6.一氧化碳与氢气在一定条件下发生反应的化学方程式是2CO+4H2═X+H2O.下列分析正确的是()
A.X与CO的相对分子质量之差为16 B.X中只含C、H元素
C.该反应的基本类型是置换反应 D.X中C、H元素质量比为4:1
解析:反应物中含有2个碳原子、2个氧原子、8个氢原子,生成物中含有2个氢原子、1个氧原子,所以X的化学式中需要含有2个碳原子、1个氧原子、6个氢原子,所以化学式是C2H6O.
A、C2H6O的相对分子质量为12×2+1×6+16=46,CO的相对分子质量为:12+16=28,二者只差为:46﹣28=18,故A错误;
B、根据求出的X可知,X中含有碳、氢、氧三种元素,故B错误;
C、置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,故C错误;
D、X中碳、氢元素质量比为:(12×2):(1×6)=4:1,故D正确
故选D
7.如图,下列各组变化中,每一步转化在一定条件下均能一步实现的是()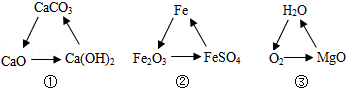
A.①② B.①③ C.②③ D.①②③
解析:①碳酸钙高温煅烧生成氧化钙和二氧化碳,氧化钙和水反应生 成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙白色沉淀和水;
成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙白色沉淀和水;
②中氧化铁不能直接转化为硫酸亚铁;
③水通电生成氧气,氧气和镁在点燃的条件下生成氧化镁,氧化镁和酸反应生成水.
只有②不可以,故选B
8.如图是甲、乙、丙三种物质(均不 含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在).下列说法正确的是()
含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在).下列说法正确的是()
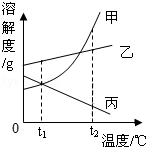
A.将原饱和溶液温度由t2℃降到t1℃时,所得三种溶液一定都是饱和溶液
B.将原饱和溶液分别蒸发等量水后恢复至t2℃时,析出溶质的质量丙>乙>甲
C.将原饱和溶液温度由t2℃降到t1℃时,所得溶液中溶质的质量分数由大到小的顺序为:乙>甲>丙
D.将原饱和溶液温度由t2℃降到t1℃时,析出甲的质量一定比乙多
解析:A、根据溶解度曲线可知甲乙由于溶解度随温度的降低溶解度减小,所以有晶体析出,仍为饱和溶液,而丙的溶解度随温度的降低溶解度增大,所以丙变为不饱和溶液,故错;
B、不知甲乙丙的原饱和溶液是否相等,无法确定析出溶质的质量的多少,故错;
C、可知t2℃时甲乙丙三种物质的质量分数大小关系为:甲>乙>丙,降温到t1℃时,甲乙由于溶解度随温度的降低溶解度减小,所以有晶体析出,质量分数减小,乙大于甲,而丙的溶解度随温度的降低溶解度增大,所以丙变为不饱和溶液,质量分数不变,所以三者质量分数大小顺序为:乙>甲>丙,故对;
D、不知甲乙的原饱和溶液是否相等,无法确定析出溶质的质量的多少,故错;
答案C
二、填空题(每空1分,共16分)
9.
(1)写出下列物质的化学式:
①甲烷_________;②硫酸铁_________.
(2)写出下列反应的化学方程式:
①乙醇燃烧:_________;
②硫酸钠溶液和氢氧化钡溶液反应:_________.
解析:(1)①甲烷的化学式为:CH4;
②硫酸铁中铁元素显+3价,硫酸根﹣2价,其化学式为Fe2(SO4)3.
(2)①乙醇燃烧生成 水和二氧化碳,故化学方程式为:C2H5OH+3O2
水和二氧化碳,故化学方程式为:C2H5OH+3O2 2CO2+3H2O;
2CO2+3H2O;
②硫酸钠与氢氧化钡反应生成硫酸钡白色沉淀和氢氧化钠,故化学方程式为:Na2SO4+Ba(OH)2=BaSO4↓+2NaOH.
故答案为:(1)①CH4;②Fe2(SO4)3;(2)①C2H5OH+3O2 2CO2+3H2O;②Na2SO4+Ba(OH)2=B
2CO2+3H2O;②Na2SO4+Ba(OH)2=B aSO4↓+2NaOH
aSO4↓+2NaOH
10.如图中A、B分别是某微粒的结构 示意图,回答下列问题:
示意图,回答下列问题:
(1)若A是某阴离子的结构示意图,则x可能是下列中的_________(填字母序号)
a.8b.10c.11d.12
(2)若B表示某原子的结构示意图,则y=_________.
(3)若A中x=12,则A、B所表示的元素形成化合物的名称为_________.
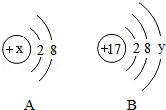
解析:(1)在阴离子中,核内质子数<核外电子数,所以x小于10,故x可能是8;故选:a;
(2)当核电荷数=质子数=核外电子数,为原子,所以若B表示某原子的结构示意图,则y=17﹣2﹣8=7;故填:7;
(3)A中x=12,则A是镁元素,该结构示意图是镁离子,B是氯元素,形成的是氯离子,故形成的化合物是氯化镁,故填:氯化镁.
11.根据下列 装置图回答问题.
装置图回答问题.
(1)图中标示①仪器的名称是_________.
(2)实验室制取二氧化碳气体时,发生装置可选择图中的_________(填装置编号),反应的化学方程式为_________.
(3)采用上述方法制取的二氧化碳中常含有氯化氢气体和水蒸气.为获得纯净、干燥的二氧化碳气体,可选用如图所示的F装置和G装置进行除杂和干燥,导管口连接的正确顺序是:气体→(_________)→(_________)→(_________)→(_________)→D.
(4)若将装置A和D连接制取并收集氧气,其中装置A中的试管口略向下倾斜的目的是_________.证明氧气已收集满的方法是_________.
解析:(1)图中标示①仪器的名称是酒精灯,常用作热源.
故填:酒精灯.
(2)碳酸钙和稀盐酸反应不需要加热,应该用B装置作为发生装置,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.
故填:B;CaCO3+2HCl═CaCl2+H2O+CO2↑.
(3)导管口连接的正确顺序是:气体先通过c导管进入饱和碳酸氢钠溶液中,除去氯化氢后通过d导管导出,再通过a导管进入浓硫酸中,干燥二氧化碳,再由b导管导出,通过D装置可以收集到干燥的二氧化碳.
故填:c;d; a;b.
a;b.
(4)其中装置A中的试管口略向下倾斜的目的是防止水蒸气冷凝、回流炸裂试管;
证明氧气已收集满的方法是把带火星的木条放在集气瓶口,如果带火星的木条复燃,说明已经收集满.
故填:防止水蒸气冷凝、回流炸裂试管;把带火星的木条放在集气瓶口,如果带火星的木条复燃,说明已经收集满
12.星期天,小明做完作业后准备和妈妈一起做午饭.妈妈告诉他,午饭除了米饭外,还准备做家常豆腐、糖醋排骨和蹄花汤.
(1)为了均衡营养,你认为还应该增加的一道菜是_________.
(2)小明和妈妈将菜洗好、切好后,准备炒菜.他洗锅时发现他家的铁炒锅生锈了.为了防止铁锅生锈,你给他的建议是_________.
(3)在洗菜、做饭、炖汤时都用到的水.我们使用的水是经过自来水厂处理过的.水的净化可以用明矾、活性炭等.但目前广泛用于自来水净化的是集氧化、吸附、凝聚、杀菌等功能于一体的消毒剂高铁酸钠(Na2FeO4).高铁酸钠中铁元素的化合价为_________.
解析:(1)午饭中的营养物质有糖类、蛋白质、油脂、水和无机盐,比较缺乏的营养物质是维生素.为了均衡营养,还应该增加的一道菜是炒青菜;
(2)为了防止铁锅生锈,人们常采用保持铁锅表面的洁净干燥或在将铁锅擦干,涂上一层植物油等方法,这些方法都能够防止锈蚀的原理是隔绝氧气和水;
(3)在Na2FeO4中,Na元素的化合价为+1价,O元素的化合价为﹣2价,设该化合物中Fe元素的化合价为x,由化学式和化合物中正负化 合价的代数和为0,则(+1)×2+x+(﹣2)×4=0,解得x=+6.
合价的代数和为0,则(+1)×2+x+(﹣2)×4=0,解得x=+6.
故答案为:(1)炒青菜;
(2)保持铁锅表面的洁净干燥;
(3)+6
三、推断与探究题(共16分)
13.如图表示某些物质间转化关系(反应条件和部分产物已省略).常温下A、C是由相同元素组成的无色液体.且A具有消毒杀菌作用;D、I、J均为无色气体,其中I能使澄清的石灰水变浑浊;K为红棕色粉末.请回答下列问题:
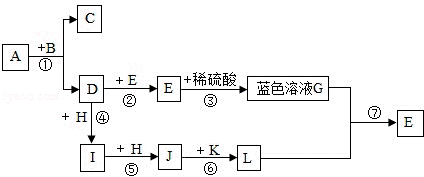
(1)反应①中B物质的作用是_________.
(2)图中标出的反应①到⑦中是化合反应的是_________(填数字序号).
(3)在图中标出的12种物质中,单质有_________种.
(4)反应②中的现象为_________.
(5)写出I使澄清的石灰水变浑浊的化学方 程式_________.
程式_________.
解析:
解析:常温下A、C是由相同元素组成的无色液体,且A具有消毒杀菌作用,A分解会生成C和无色气体D,所以A是过氧化氢溶液,C是水,D是氧气,B就是二氧化锰,I能使澄清的石灰水变浑浊,所以I是二氧化碳,氧气和H会生成二氧化碳,二氧化碳和H会生成J.所以H是木炭,J是一氧化碳,F和稀硫酸会生成蓝色溶液G,所以G是硫酸铜溶液,氧气和E会生成F,所以F是氧化铜,E是铜,一氧化碳和红色粉末K会生成L,所以K是氧化铁,L就是铁,铁和硫酸铜反应生成铜和硫酸亚铁,经过验证,推出的各种物质均满足题意,推导合理.
(1)通过推导可知B是二氧化锰,二氧化锰可以加快过氧化氢的分解,而本身的质量和化学性质在反应前后不变,所以二氧化锰是该反应的催化剂;
(2)反应①是分解反应,反应②是化合反应,反应③是复分解反应,反应④是化合反应,反应⑤是化合反应,反应⑥不属于反应基本类型,反应⑦是置换反应,所以图中标出的反应①到⑦中是化合反应的是:②④⑤;
(3)A过氧化氢溶液是混合物,B二氧化锰是氧化物,C水是氧化物,D氧气是单质,E铜是单质,F氧化铜是氧化物,G硫酸铜是盐,H木炭是单质,I二氧化碳是氧化物,J一氧化碳是氧化物,K氧化铁是氧化物,L铁是单质,所以在图中标出的12种物质中,单质有4种;
(4)反应②是铜和氧气在加热的条件下生成氧化铜,反应现象是:红色固体变成黑色;
(5)二氧化碳和氢氧化钙反应生成白色的碳酸钙沉淀和水,化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
故答案为:(1)催化作用;
(2)②④⑤;
(3)4;
(4)红色固体变成黑色;
(5)Ca(OH)2+CO2=CaCO3↓+H2O.
14.某同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液中滴加稀盐酸一会儿后,发现忘记了滴加指示剂.因此,他停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行了如下探究,请你和他一起完成探究活动.
【提出问题】溶液中的溶质是什么物质?
【作出猜想】猜想一:溶质只有氯化钙;、
 猜想二:可能是CaCl2和Ca(OH)2;
猜想二:可能是CaCl2和Ca(OH)2;
猜想三:_________.
【查阅资料】氯化钙溶液呈中性.
【方案设计】
方案 | 方法步骤 | 实验现象 | 实验结论 |
方案一 | 取少量烧杯内的溶液于试管中,滴入几滴无色酚酞溶液 | 酚酞不变色 | 猜想一正确 |
酚酞变红色 | 猜想二正确 | ||
方案二 | 取少量烧杯内的溶液于试管中,逐滴加入_________溶液至过量 | _________ | 猜想三正确 |
【方案评价】该同学与同学们通过讨论认为:
(1)方案一能证明猜想二正确,但不能证明猜想一正确.
(2)方案二可行.但该同学在记录时未记录完整,请你帮他将方案二补充完整.
【方案反思】方案一不能证明猜想一正确的理由是_________.
【拓展与应用】实验证明猜想三是正确的.要想使溶液中的溶质只有氯化钙,你认为应该进行的实验步骤是_________.
【结论】在分析化学反应后所得物质成分时,除考虑生成物外还需考虑_________.
解析:【作出猜想】反应可能是恰好反应,只有氯化钙(猜想二)、也可能是一种物质完全反应,另一种物质有剩余,若氢氧化钙过量,则含有氢氧化钙和氯化钙(猜想一);若盐酸过量,则含有盐酸和氯化钙(猜想三);
【方案设计】盐酸能和碳酸钠反应生成氯化钙、水和二氧化碳,若有气泡冒出,则说明溶液中有盐酸和 氯化钙;
氯化钙;
【方案反思】酚酞遇碱变红,在中性和酸性时都不变色,所以通过酚酞不变色就认定只有氯化钙(中性)不全面,还可能是含有盐酸和氯化钙(溶液为酸性);
【反思与拓展】实验步骤是:向废液中加入碳酸钙,当不再产生气泡时,停止加入碳酸钙,过滤既 得只含有氯化钙的废液.
得只含有氯化钙的废液.
【结论】因为反应可能是完全反应,也可能是其中的一种反应物过量,因此在分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物的用量;
故答案为:【作出猜想】含有盐酸和氯化钙;
【方案设计】碳酸钠;有气泡冒出
【方案反思】酚酞不变色还可能是含有盐酸和氯化钙;
【反思与拓展】向废液中加入碳酸钙,当不再产生气泡时,停止加入碳酸钙,过滤既得只含有氯化钙的废液.
【结论】反应物是还过量
四、计算题(共4分)
15.实验室有一瓶未用完的长期敞口放置的氢氧化钠样品(不考虑水的存在),质量是9.3g,与一定质量分数的稀盐酸92.9g恰好完全反应,产生气体的质量为2.2g.试计算完全反应后所得溶液中溶质的质量分数.(写出具体计算过程)
解析:设碳酸钠的质量为x,碳酸钠和盐酸反应生成氯化钠的质量为y,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 1 17 44
17 44
x y 2.2g
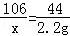
x=5.3g y=5.85g
样品中氢氧化钠的质量=9.3g﹣5.3g=4g
设氢氧化钠和盐酸反应生成氯化钠的质量为z.
NaOH+HCl=NaCl+H2O
40 58.5
4g z
z=5.85g
完全反应后所得溶液中溶质的质量分数=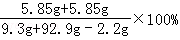 =11.7%
=11.7%
答:完全反应后所得溶液中溶质的质量分数是11.7%.


