(单词翻译:单击)
一、选择题(本题包括20小题,每小题2分,共40分。每小题只有一个选项符合题意)
1.(2012•常州)下列关于铝的自我介绍中,属于描述其化学性质的是( )
A.我是银白色金属 B.我具有良好的导电性
C.我能在氧气中燃烧 D.我具有良好的延展性
答案:C
2.英国为迎奥运建造的“哈伯泡泡塔”高115m,使用了1400t钢铁,堪称英国最大的公共艺术建筑,钢铁属于( )
A.非金属材料 B.金属材料C.有机合成材料 D.复合材料
答案:B
3.下列仪器不能用酒精灯直接加热的是( )
A.蒸发皿 B.试管 C.烧杯 D.燃烧匙
答案:C
4.下列属于非金属元素的是( )
A.碘 B.金 C.镁 D.铜
答案:A
5.下列厨房中的物质(或其主要成分)由离子构成的是( )
A.蔗糖 B.食盐 C.植物油 D.黄酒
答案:B
6.下列不是铁丝在氧气中燃烧的现象的是( )
A.火星四射 B.放热C.生成黑色固体 D.产生刺激性气味的气体
答案:D
7.下列生活中的行为,有利于改善空气质量的是( )
A.燃放烟花爆竹 B.禁止露天焚烧垃圾C.在居室内吸烟 D.工厂任意排放废气
答案:B
8. 下列实验操作错误的是( )
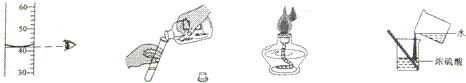
A.读出水的体积 B.倾倒液体 C.点燃酒精灯 D.稀释浓硫酸
答案:D
9.古代“银针验毒”的原理是:4Ag+2H2S+O2═2X+2H2O,X的化学式为( )
A.AgS B.Ag2O C.Ag2S D.Ag2O2
答案:C
10.下列防锈措施不合理的是( )
A.擦去铝锅表面的氧化膜 B.在自行车链条上涂油
C.在车船的表面喷涂油漆 D.在铁制水管表面镀锌
答案:A
11.在一定条件下,下列转化不能由一步反应实现的是( )
A.H2CO3→CO B.Fe2O3→Fe C.CO2→CaCO3 D.H2SO4→MgSO4
答案:A
12.铬广泛应用于电镀、颜料等多种化工生产中,但生产过程中排放出的铬渣中含有铬酸钙等致癌物,会持久损害地下水和农田.因此,我国采取了一系列措施控制铬污染.铬酸钙(CaCrO4)中铬元素的化合价为( )
A.0 B.+3 C.+4 D.+6
答案:D
13.铬广泛应用于电镀、颜料等多种化工生产中,但生产过程中排放出的铬渣中含有铬酸钙等致癌物,会持久损害地下水和农田.因此,我国采取了一系列措施控制铬污染.下列措施不利于控制铬污染的是( )
A.严格限制有毒铬的使用 B.禁止使用有毒铬的工艺
C.将有毒铬渣深埋地底 D.清理被铬渣污染的水土
答案:C
14.垃圾处理的一项有效方式是将其分类回收利用,既节约资源,又防止污染,符合可持续发展的要求.下列可投入如图所示垃圾桶的是( )

A.破旧布娃娃 B.大理石废料 C.玻璃瓶 D.破碎瓷器
答案:A
15.草甘膦(C3H8NO5P)是一种常见除草剂,下列关于其叙述错误的是( )
A.属于有机物 B.由5种元素组成
C.碳、氢元素的质量比为3:8 D.1个草甘膦分子还有18个原子
答案:C
16.下列括号中是除去少量杂质所用的方法或试剂,其中错误的是( )
A.CaO中的CaCO3(高温煅烧) B.CO2中的CO(点燃)
C.N2中的O2(灼热铜丝) D.Na2SO4溶液中的NaOH(H2SO4
答案:B
17.如图,向2支试管中分别加入等量清水和红墨水,使其有较明显的分界面,将其中1支试管放入盛有热水的烧杯中,观察到:浸在热水中的试管里的两种液体分界面模糊的更快些.该对比实验主要说明构成物质的微粒( )
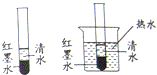
A.体积小、质量小 B.在不断运动
C.相互之间有间隙
D.随温度升高运动速度加快
答案:D
18.如图,在密封的纸盒上挖一个直径10cm的圆形小洞,并在洞口前方约1米的位置,放置一根点燃的蜡烛,用双手在纸盒两侧拍击,蜡烛熄灭.蜡烛熄灭的主要原因是( )
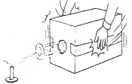
A.缺乏可燃物 B.缺乏O2
C.排出的气流中CO2的含量高
D.温度降到了可燃物的着火点以下
答案:D
19.向Fe(NO3)2、Mg(NO3)2和Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后过滤.下列关于得到的溶液或滤渣的叙述正确的是(不考虑溶液中存在微量H+和OH―)( )
A.若滤液中含有Fe2+,则滤渣中一定不含Fe
B.若滤渣中含Cu,则滤液中一定含Fe2+
C.若滤渣中含Zn,则滤液中含2种离子
D.若滤渣中不含Zn,则滤液中至少含3种离子
答案:D
20.将0.8g草酸亚铁(FeC2O4)放在一个可称量的敞口容器中加热灼烧,固体质量随温度升高而变化的数据如下(下表中所注明的各温度下,容器中的固体均为纯净物):
温度(℃) | 25 | 350 | 400 | 500 | 600 | 900 |
固体质量(g) | 0.80 | 0.80 | 0.40 | 0.44 | 0.44 | 0.43 |
下列叙述错误的是( )
①400℃时,容器中的固体为碳酸盐;
②400℃~500℃,发生了化合反应;
③600℃~900℃,发生的反应可表示为:6Fe2O3  4Fe3O4 +O2↑
4Fe3O4 +O2↑
A.仅① B.仅①② C.仅①③ D.仅②③
答案:A
二、非选择题(本题包括共4小题,满分20分)
21.(1)写出下列物质的名称、俗称或化学式.
名称 | 固态二氧化碳 | ② | 氢氧化钠 | 碳酸钠 |
俗名 | ① | 生石灰 | ③ | 纯碱 |
化学式 | CO2 | CaO | NaOH | ④ |
答案:① 干冰; ② 氧化钙 ;③ 火碱(烧碱、苛性钠);④ Na2CO3
(2)判断下列物质的类别,并用相应的序号填空.
①单质 ②氧化物 ③酸 ④碱 ⑤盐
物质化学式 | KOH | SO2 | (NH4)2SO4 |
物质类别 |
答案:碱 氧化物 盐
22.用符合要求的物质的序号填空.
①氧气 ②浓硫酸 ③碳铵 ④熟石灰 ⑤聚乙烯
(1)实验中,可用作干燥剂的是: ②④ ;
(2)生产中,可用于制作食品包装袋的是: ⑤ ;
(3)医疗上,在抢救危重病人时,用呼吸机输入的是: ① ;
(4)农业上,可作为肥料使用的是: ③ .
23.最近网络上流行着一个有趣的实验“大象的牙膏”:在细长的容器中加入双氧水和发泡剂(用于产生泡沫),仅看到少量泡沫,然后向其中加入少量物质M,立即看到大量泡沫迅速从瓶口喷出,源源不断就像挤不完的牙膏.
(1)M的作用是 催化作用 ;
(2)写出有关的化学方程式: 2H2O2 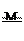 2H2O+O2↑ ;
2H2O+O2↑ ;
(3)用溶质质量分数较大的双氧水做此实验将获得更好的喷发效果,原因是: 溶质质量分数越大,反应越剧烈.
24.如图是为探究物质燃烧条件设计的实验.甲中的白磷未燃烧,而乙中的白磷发生了燃烧.
(1)该实验主要探究的燃烧条件是 燃烧需要氧气 ;
(2)白磷(P4)燃烧的产物与红磷相同,请写出白磷燃烧的化学方程式: 4P+5O2  2P2O5 ;
2P2O5 ;
(3)如仅用该装置进行实验,验证空气中氧气的体积分数约为 ,应做到:①白磷 足量;②将锥形瓶B 密封好.
25.以下是今年我市实验操作考察的内容,请回答相关问题.
【实验目的】证明氢氧化钠溶液与稀盐酸发生了反应且生成了新物质;
【实验原理】
HCl+NaOH═NaCl+H2O (用化学方程式表示);
【药品仪器】
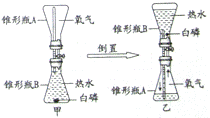
【实验步骤】
①取 A
(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用 G
(填仪器名称)向①中溶液滴加稀盐酸,直至红色消失;
③向②中溶液继续滴加过量稀盐酸,溶液保持无色;
④用F蘸取③中溶液,在酒精灯上灼烧,有白色固体产生.
【思考拓展】
(1)步骤③的目的是: 充分反应掉所有的氢氧化钠 ;
(2)如不使用酸碱指示剂,进一步确认步骤④中的白色固体不是氢氧化钠的方法是:
取少量水将其溶解,观察温度的变化 ;
(3)已知酚酞试液在不同pH时的变色情况如下表.某同学发现:向某氢氧化钠溶液中滴加酚酞试液后,溶液显无色;逐滴滴加稀盐酸,溶液先变红,后褪至无色.你认为该氢氧化钠溶液滴加酚酞试液显无色的原因可能是: 浓度过大
.请设计实验证明你的猜想(写出简要的操作步骤与现象:
取少量的浓氢氧化钠于烧杯中,向其中滴入酚酞试液,如果颜色为无色,然后用水稀释,再滴入酚酞试液,颜色变为红色,则证明猜想正确
pH | <8.2 | 8.2~10.0 | >10.0 |
颜色 | 无色 | 红色 | 无色 |
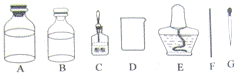
26.某研究性学习小组利用如图所示实验装置进行了以下探究实验.步骤如下:
①检查装置气密性,加入锌粒和稀硫酸;
②关闭K2、打开K1,待气泡连续均匀产生,立即关闭K1、打开K2,并开始计时;
③待丁中收集到10mL水,结束计时;
④换不同溶质质量分数、不同体积的稀硫酸,与质量相同的同一种锌粒重复上述实验;
⑤将每次实验的数据记录于下表:
硫酸用量(mL) | 40 | 40 | 20 | 20 | 20 | 10 | 10 |
硫酸的溶质质量分数(%) | 9.8 | 39.2 | 9.8 | 19.6 | 39.2 | 19.6 | 39.2 |
收集所用时间 | 4′03 | 1′36 | 4′12 | 3′30 | 1′40 | 3′42 | 1′48 |
(1)写出乙中反应的化学方程式: Zn+H2SO4═ZnSO4+H2↑ ;
(2)该实验的目的是: 探究溶液的溶质质量分数对反应速率的影响
(3)上述实验证明: 硫酸的溶质质量分数 对该反应中氢气产生的速率有显著影响;
(4)若要快速制取大量氢气,可在乙中加入几滴硫酸铜溶液,但加入的量不可过多,原因是: Zn+CuSO4═ZnSO4+Cu (用化学方程式表示).

27.如图是某浓盐酸试剂瓶上标签的部分内容.(1)将浓盐酸敞口放置,其质量分数会变小,这是由于浓盐酸具有较强的 挥发性 ,所以浓盐酸必须密封保存;
(2)将该瓶浓盐酸全部配制成溶质质量分数为11.8%(密度约为1.06g/mL)的盐酸,需加入水 1210 mL(ρ水=1g/mL);
(3)含杂质40%的石灰石100g与足量稀盐酸充分反应,理论上可得到CO2多少克?(假设杂质不与稀盐酸反应)17.6g
28.下表列出了KNO3与NaCl在不同温度时的溶解度:
温度(℃) | 0 | 10 | 20 | 40 | 60 | 80 | 100 |
KNO3的溶解度(g) | 13.3 | 20.9 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCl的溶解度(g) | 35.7 | 35.8 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
(1)现有含123gKNO3与17.9gNaCl的混合物,某同学设计了以下实验除去KNO3中的NaCl(操作过程中不考虑额外的水损失).
①向混合物中加入适量水,加热溶解;
②继续加热溶液至100℃并恒温蒸发浓缩;
③将溶液降温至10℃,仅得到KNO3晶体,过滤,将所得KNO3晶体洗涤并干燥.
A.步骤②中,为确保没有晶体析出,溶液中至少要保留 50g水;
B.步骤③中,最多可得到KNO3晶体112.55 g;
C.根据上述实验可概括出除去KNO3中少量NaCl的主要步骤:
加热溶解→蒸发浓缩→ 降温 →过滤→洗涤→干燥;
D.洗涤时,应选用少量 冷水 (选填“热水”或“冷水”).其目的是: 防止温度高硝酸钾又溶到水中 ;
(2)除去NaCl中少量KNO3的一种方法是:将NaCl和KNO3的混合物置于适量水中,加热,搅拌,待KNO3全部溶解,趁热过滤,将过滤所得的NaCl晶体进行洗涤和干燥.上述方法中,趁热过滤的目的是:
温度高硝酸钾的溶解度大,不会析出
(3)取23.4gNaCl和40.4gKNO3,加70g水,加热溶解.在100℃时蒸发掉50g水,维持该温度过滤,得到的晶体质量为 15.44 g;将滤液冷却至10℃,充分结晶,写出析出的晶体的化学式: NaCl、KNO3 .
29.甲、乙、A~G九种物质之间具有如图所示转化关系(反应条件均已略去).已知:A在空气中缓慢氧化生成的主要物质为B,E为黑色固体,D和F的组成元素相同,甲是米、面等食物的主要成分,一氧化碳可与某些金属氧化物在一定条件下反应得到金属单质.回答下列问题:
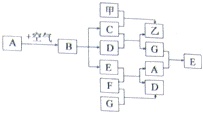
(1)写出空气中与A反应的物质的化学式: CO2、H2O ;
(2)B物质与稀盐酸反应的现象为:固体逐渐减小,有气泡冒出,溶液的颜色变为蓝色
(3)写出E+F→A+D的化学方程式:CuO+CO 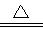 Cu+CO2
Cu+CO2
(4)检验物质甲的方法是: 用碘水,碘遇淀粉变蓝
30.如图是太阳能燃料电池的组成与功能示意图,请据图回答下列问题:
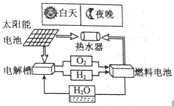
(1)电解槽的作用是电解水,写出该反应的化学方程式:
2H2O  2H2↑+O2↑
2H2↑+O2↑
(2)夜晚,太阳能燃料电池工作时的能量转化途径为 B(填序号);
A.太阳能→电能→热能 B.化学能→电能→热能
C.太阳能→化学能→电能→热能 D.电能→化学能→电能→热能
(3)太阳能燃料电池中可循环使用的原料是 水;
(4)与单一的太阳能电池相比,太阳能燃料电池的优点是 晚上也可以使用 .
31.6月1日是“世界国际牛奶日”,其目的是宣传牛奶的营养价值和对人体健康的重要性等.

(1)牛奶含有 钙元素,常喝牛奶能防止骨骼疏松、得佝偻病;
(2)人体发生重金属盐中毒时,可以喝牛奶缓解中毒症状,这是因为牛奶中含有蛋白质 ;
(3)婴幼儿常通过奶粉冲调的牛奶补充生长必须的营养元素,冲调奶粉的水温应控制在40~50℃为宜,因为过高的温度会 破坏牛奶中的营养物质;
⑷牛奶不能与含有草酸(H2C2O4)的巧克力同食,因为草酸会与牛奶中溶有的钙的化合物(假设其化学式为CaX2)反应,生成不溶性的草酸钙,影响钙的吸收.写出该反应的化学方程式:H2C2O4+CaX2=CaC2O4↓+2HX


