(单词翻译:单击)
9.自来水的生产过程主要包括以下流程,其中发生化学变化的是 【 】
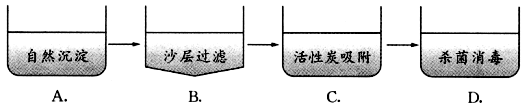
解析:自然沉淀、过滤和活性炭吸附作用都是物理变化,只有杀菌消毒是化学变化。故选D。

11.氧气是与人类关系最密切的一种气体。下列与氧气有 关的说法正确的是【 】
关的说法正确的是【 】
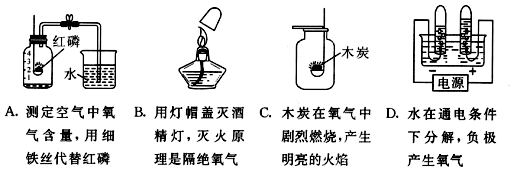
解析:细铁丝在空气中不能燃烧,不能用铁丝代替红磷;用灯帽盖灭酒精灯的原理是与氧气隔绝开来,B正确;木炭在氧气中燃烧是发出白光放出热量,没有火焰,C不对;电解水的时候正极产生的是氧气,负极产生的是氢气,D不对。故选B。
12.在化学王国里,数字被赋予了丰富的内涵。对下列化学用语中数字“2”的说法正确的是【 】
①2H ②2NH3 ③SO2 ④O ⑤Mg2+ ⑥2OHˉ ⑦H2O
A. 表示离子个数的是⑤⑥ B. 表示离子所带电荷数的是④⑤
C. 表示分子中原子个数的是③⑦ D. 表示分子个数的是①②
解析:①中表示的是原子个数,②表示的分子个数,③、⑦表示的分子中原子的个数,④表示的是化合价,⑤表示的是离子所带电荷数,⑥表示的是离子个数,故选C。
13.不含有害物质的明胶,可以在制药与食品工业中使用。明胶里含有多种蛋白质,其中某蛋白质在人体内水解产物之一为苯丙氨酸(化学式为C9H11O2N)。下列对相关物质的说法正确【 】
A. 苯丙氨酸由23个原子构成 B. 苯丙氨酸分子由碳、氢、氧、氮四种元素组成
C. 苯丙氨 酸为有机物,明胶为混合物 D. 苯丙氨酸中氢元素的质量分数最大
酸为有机物,明胶为混合物 D. 苯丙氨酸中氢元素的质量分数最大
解析:A中苯丙氨酸是由分子构成的物质,所以A错误;苯丙氨酸分子是微观粒子,应该对应由碳、氢、氧、氮四种原子构成,B错误;苯丙氨酸中含有碳元素,是有机物,明胶中含有多种蛋白质,应为混合物,C正确;苯丙氨酸中碳元素的质量分数最大,D错误。故选C。
14.某密闭容器中有X、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表。根据表中信息,判断下列说法正确的是【 】
物质 | X |
| CO2 | H2O |
反应前质量/g | 16 | 70 | 1 | 0 |
反应后质量/g | 0 | 待测 | 45 | 36 |
A. 该反应为置换反应 B. X中一定含有碳、氢两种元素
C. 表中“待测”值为5 D. 反应生成的CO2和H2O的质量比为45:36
解析:由表可知,X为反应物,参加反应的物质质量为16g;CO2反应前为1g,反应后为45g,所以是生成物,生成的质量为44g;同理,H2O为生成物,生成的质量为36g;根据质量守恒定律,氧气应为反应物,反应的质量为64g,故待测值为6,C不正确;根据质量守恒定律,元素种类守恒,X中一定含有碳、氢两种元素,B正确;反应生成的CO2和H2O的质量比为44:36,D不正确;故选B。
15.下图为初中化学常见气体的发生与收集装置 。有关这些装置的说法不正确的是 【 】
。有关这些装置的说法不正确的是 【 】
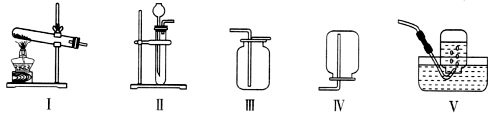
A. 装置I可作为固体加热制取气体的发生装置
B. 装置Ⅱ中长颈漏斗可以用分液漏斗、医用注射器代替
C. 装置Ⅲ、Ⅳ可用于收集密度与空气密度差距较大,且不与空气中各成分反应的气体
 D. 装置Ⅴ可以用于收集H2、O2,也可以用于实验室收集CO2
D. 装置Ⅴ可以用于收集H2、O2,也可以用于实验室收集CO2
解析:装置Ⅴ为排水法收集气体,适用于难溶于水的气体收集,CO2能溶于水,所以不能用来收集CO2,故选D
二、填空及简答题(共5小题。计19分)
16.(每空l分,共3分)Ⅰ、Ⅱ两小题只选 做一题,如果两题全做。只按Ⅰ题计分。
做一题,如果两题全做。只按Ⅰ题计分。
I. 我国南海海域辽阔,那里散布着范围最广的珊瑚礁群,蕴含有巨量的矿产资源、渔业资源等,有“第二个波斯湾”之称。
(1)南海海域鱼类众多,产量丰富。鱼类能提供的有机营养素主要为 。
(2)南海已成为我国最大的海上化石燃料生产基地。写出你知道的一种化石燃料 。(3)矿产资 源属于不可再生资源,在开发和利用中一定要增强保护意识。保护金属资源的措施有 (答一条即可)。
源属于不可再生资源,在开发和利用中一定要增强保护意识。保护金属资源的措施有 (答一条即可)。
解析:鱼类富含蛋白质,三大化石燃料为煤、石油和天然气,保护金属资源的方法可以从开采、寻找代用品、防腐、回收四方面来考虑。
答案:(1)蛋白质 (2)煤;或石油;或天然气 (3) 有计划、合理地开采;或寻找代用品;或防止锈蚀;或加强废旧金属的回收再利用
Ⅱ. 据《陕西日报》2012年1月20日报道,铜川市某养殖专业户修建的沼气池,日产沼气600立方米,免费供给村民使用。沼气是用稻草、麦秆、人畜粪便等在密闭的沼气池中发酵产生的。
(1)沼气作燃料利用其 (选填“物理”或“化学”)性质。
(2)沼气的主要成分是 。
(3)用沼气作燃料,与用煤相比能减少的空气污染物有 (答一种即可)。
解析:燃烧是利用燃料的化学性质,沼气的主要成分是甲烷,甲烷是一种气体,燃烧比较充分,燃烧的时候可以减少可吸入颗粒物的排放,不含氮元素和硫元素,不会排放出二氧化氮和二氧化硫。
答案:(1)化学 (2)甲烷或CH4 (3)可吸入颗粒物;或SO2;或NO2
17.(3分)人体中必需的微量元素铁、氟、锌、硒、碘等,虽然含量少,但对健康至关重要。下面提供几种微量元素的相关信息,请认真分析并回答下列问题:
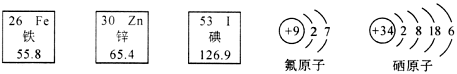
(1)上述微量元素中属于非金属元素的有 种。
(2)铁原子核外电子数为 。
(3)硒原子在化学反应中容易得到2个电子,形成 (选填“阴”或“阳”)离子。
解析:利用原子序数等于电子数知铁原子核外电子数为26,硒原子容易得电子,带负电荷,所以是阴离子。
答案:(1)三或3 (2)26 (3)阴
18.(4分)分类归纳是化学学习的重要方法。下面是某同学对所学物 质的分类归纳,请仔细分析并回答下列问题:
质的分类归纳,请仔细分析并回答下列问题:
(2)在分类所列举的物质中,有一种物质归类
错误,这种物质是 。
(3)选择分类物质中 的
的 一种,写出一个有单质
一种,写出一个有单质
生成的分解反应的化学方程式(条件所需物质不
受所列物质限制) 。
解析:C组中均为氢氧化物,为碱类,B组中HCl、H2SO4为酸类,NH4HCO3 属于盐类,有单质生成的反应可以写制氧气的反应。
答案:(1)碱 (2)NH4HCO3或碳酸氢铵
(3)2H2O2 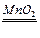 2H2O + O2 ↑或 2KMnO4
2H2O + O2 ↑或 2KMnO4  K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
19.(4分)20C时,将等质量的甲、乙两种固体物质,分别加人到盛有100g水的烧杯中,充分搅拌后现象如图 1,加热到50C时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题:
1,加热到50C时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题:
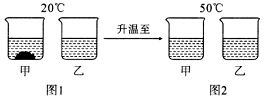
(1)图1中一定为饱和溶液的是 。
(2)图2中甲、乙两 溶液中溶质质量分数的大小关系为 。
溶液中溶质质量分数的大小关系为 。
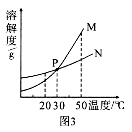
(3 )图3中表示乙的溶解度曲线是 ;P点表示的含义是 。
)图3中表示乙的溶解度曲线是 ;P点表示的含义是 。
解析:甲中有未溶解固体存在,故甲一定是饱和溶液,升温后,两杯中均无晶体存在,水均为100g,所加甲、乙固体的质量相等,所以质量分数相等;20℃时,甲中有未溶解的固体,说明20℃时,甲的溶解度小于乙的溶解度,故表示乙溶解度曲线的是N,P点为两线的交点,表示30℃时,甲、乙两种固体的溶解度相等。
答案:(1)甲 (2)相等或甲=乙 (3)N 30℃时,甲、乙两种固 体物质的溶解度相等
体物质的溶解度相等
20.(5分)下图为某学习小组探究金属化学性质时所做的四个实验,仔细分析后回答下列问题:
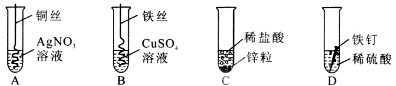
(1)描述A中的实验现象 。
。
(2)写出C中反应的化学方程式 。
(3)要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是 (填序号)。
(4)开始反应后D中溶液逐渐变为黄色,原因是 。
解析:(1)题中铜会把硝酸银中的银置换出来,同时生成硝酸铜,所以现象为铜丝表面附着一层银白色固体,溶液变为蓝色;(3)A实验可以证明Cu>Ag,B实验可以证明Fe>Cu,故只需做实验A、B就可证明Cu、Fe、Ag的活动性顺序;(4)溶液为黄色,说明有Fe3+产生,说明铁钉生锈了,没有打磨。
答案:(1)铜丝表面附着一层银白色固体,溶液变为蓝色 (2)Zn+2HCl==ZnC12+H2↑
(3) A、B (4)铁钉未打磨有铁锈;或溶液中有Fe2(SO4)3生成
三、实验及探究题(共2小题。计l2分)
21.(5分)下图是某课外学习小组设计的气体制各与性质验证的组合实验,其中装置C的作用是将二氧化碳和炭粉在高温下转化为一氧化碳。请看图回答下列问题:
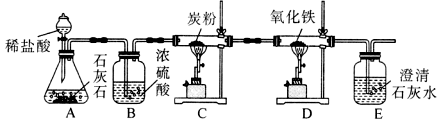
(1)写出装置A中发生反应的化学方程式 。
。
(2)装置B中浓硫酸的作用是 。(3)装置D中玻璃管内的实验现象为 。
(4)该套装置中 有一个明显的不足之处,应在装置E后放置
有一个明显的不足之处,应在装置E后放置 燃着的酒精灯处理尾气。这样做,的原因是 。
燃着的酒精灯处理尾气。这样做,的原因是 。
解析:(1)题中为实验室制取二氧化碳的反应;(2)从稀盐酸中出来的二氧化碳中混有水蒸气,用浓硫酸为了除去其中的水蒸气;(3)氧化铁是红棕色的,被还原后变成铁粉,为黑色。(4)本实验使用了CO,因为CO有毒,会污染空气,所以要加尾气处理装置。
答案:(1)CaCO3 + 2HCl === CaCl2 + H2O + CO2↑ (2)吸收CO2气体中的水分;或干燥CO2气体 (3) 红棕色固体变黑 (4)使剩余的CO全部燃 烧,防止污
烧,防止污 染空气;或CO有毒,防止污染空气
染空气;或CO有毒,防止污染空气
22.(7分)某化学课堂围绕“酸碱中和反应”,将学生分成若干小组 ,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
【学生板演】该反应的化学方程式 。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想。甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是 。【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有 。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,进行如下三个方案的探究。
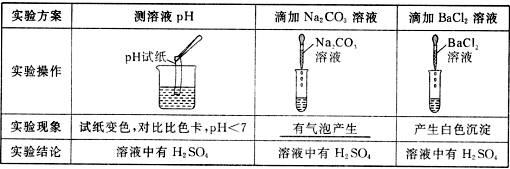
【得出结论】通过探究 ,全班同学一致确定猜想二是正确的。
,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出
四、计算与分析题(5分)
 23.在农业生产中,常用15%~20%的氯化钠溶液选种。为了
23.在农业生产中,常用15%~20%的氯化钠溶液选种。为了 测定某氯化钠溶液
测定某氯化钠溶液 是否符合要求,取该溶液70g,加入一定溶质质量分数的AgNO3溶液100g,恰好完全反应。过滤分离出沉淀的质量为28.7g。
是否符合要求,取该溶液70g,加入一定溶质质量分数的AgNO3溶液100g,恰好完全反应。过滤分离出沉淀的质量为28.7g。
(1)反应后所得溶液的质量为 141.3 g。•• ••••••••••••••••••••••••••••••••(1分)
••••••••••••••••••••••••••••••••(1分)
(2)通过计算确定该氯化钠溶液是否符合选种要求?(计算结果精确到0.1%)
解:设该氯化钠溶液中NaCl的质量为x
NaCl + AgNO3 ==== AgCl↓ + NaNO3•••••••••••••••••••••••••••••••••••••(1分)
58.5 143.5
x 28.7g•••••••••••••••••••••••••••••••••••••••••••••(1分)
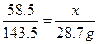 x=11.7g•••••••••••••••••••••••••••••••••••••••••(1分)
x=11.7g•••••••••••••••••••••••••••••••••••••••••(1分)
溶液中NaCl的质量分数= 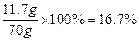
15%<16.7%<20% 符合要求••••••••••••••••••••••••••••••••••••••••• ••(1分)
••(1分)
答:该氯化钠溶液符合选种要求。


