(单词翻译:单击)
第Ⅰ卷(选择题,共60分)
一.选择题:(本题共20题,每题3分,共60分。每题仅有一个正确答案)
1. 下列变化属于化学变化的是( )
A. 铁钉生锈 B . 冰雪消融 C. 蜡烛熔化 D. 灯泡发光
. 冰雪消融 C. 蜡烛熔化 D. 灯泡发光
2. 下列说法错误的是( )
A. 在化学变化中分子可以分成原子
B. 空气由空气分子组成
C. 构成物质的粒子有分子、原子和离子等
D. 氧化物中一定含有氧元素
3. 下图所示的实验操作正确的是( )
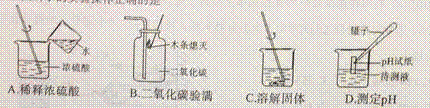
4. 化学知识在生活中有广泛的应用。下列说法错误的 是( )
是( )
A. 血红蛋白中含有铁元素,缺铁会引起人体贫血
B. 回收废弃的塑料可以减少“白色污染”
C. 肥皂水可以区分硬水和软水
D. 汽油着火可用水扑灭
5. 实验室常用二氧 化锰与浓盐酸反应制取氯气,反应的化学方程式为:
化锰与浓盐酸反应制取氯气,反应的化学方程式为:
MnO2+4HCI(浓)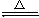 MnCl2+2X+Cl2↑,其中X的化学式为( )
MnCl2+2X+Cl2↑,其中X的化学式为( )
A. H2O B. H2O2 C. HClO D. O2
6. 如下图所示,装置气密性良好,弹簧夹处于关闭状态。挤压胶头滴管加入液体,一段时间后,打开弹簧夹,能是气球a明显鼓起的是( )
试管内物质 |
| |
A | 氢氧化钠固体 | 水 |
B | 氧化铁 | 稀盐酸 |
C | 氯化钡溶液 | 稀硫酸 |
D | 二氧化碳 | 氢氧化钠溶液 |
7. 氨气是一种密度比空气小、有刺激性气味的气体。加热条件下,氨气能将氧化铜还原成铜,反映的化学方程式为: 3CuO+2NH3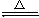 3Cu+3H2O+N2,如下图所示,挤压鼓气球把空气鼓入盛有浓氨水的集气瓶中,使氨气进入试管,用酒精灯给试管加热,即可达到实验目的。关于该实验,有下列几种说法
3Cu+3H2O+N2,如下图所示,挤压鼓气球把空气鼓入盛有浓氨水的集气瓶中,使氨气进入试管,用酒精灯给试管加热,即可达到实验目的。关于该实验,有下列几种说法
 :
:
① 实验中,试管口应略向下倾斜;
② 反应一段时间后,可看到试管内有红色物质生成;
③ 反应结束时,先撤出导气管,再熄灭酒精灯,以免液体倒流;
④ 该装置没有对尾气进行处理,会污染空气。
以上说法正确的是( )
A. ①③③④ B. ②③④ C. ①②④ D. 只有①②
8. 现有一种固体粉末状样品,已知该样品由氧化铜和铁组成。取样品少许,加入一定量的稀 硫酸,待反应停止后过滤,得到滤渣和滤液。向滤液中加入一根洁净的铁丝,铁丝表面无明显变化。关于该实验有如下说法( )
硫酸,待反应停止后过滤,得到滤渣和滤液。向滤液中加入一根洁净的铁丝,铁丝表面无明显变化。关于该实验有如下说法( )
① 该样品的颜色为黑色;
② 向样品中加入稀硫酸后,一定有气体生成,且液体颜色不变;
③ 滤渣中一定有铜,不一定有铁;
④ 滤液中含有硫酸铜和硫酸亚铁;
⑤ 滤液中溶质只有硫酸铁。
A. 2个 B. 3个 C. 4个 D. 5个
29. 根据要求用化学用语填空
(1) 甲烷的化学式______
(2) 写出氧化镁的化学式并标出镁元素的化合价_______
(3) 红磷燃烧的化学方程 式_________________________
式_________________________
30. 钾元素在人体内起调节体液平衡的作用,下图A是钾元素在周期表中的相关信息
(1) 钾元素的相对原子质量为________
(2) 右图B是钾元素形成呢过的一种粒子的结构示意图。图中x=_______,改粒子的符号是______

31. 右图是甲、乙、丙三种物质的溶解度曲线。
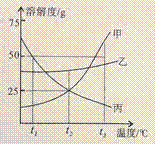
(1) t2℃时,甲的溶解度为______
(2) t3℃时,甲、乙各50g,分别加入到100g水中 ,充分搅拌。其中,不能形成饱和溶液的是_____
,充分搅拌。其中,不能形成饱和溶液的是_____
(3) t3℃时,甲的饱和溶液中含有少量的丙,现要提纯甲可采用的方法是______________
(4) 下列说法正确的是_________
A. 将甲、乙的饱和溶液分别从t1℃升温到t2℃,溶质的质量分数都不变
B. t2℃时,向100g20%甲的饱和溶液中加100g水,充分搅拌,溶液的浓度为10%
C. t3℃时,等质量的甲、乙、丙分别制成饱和溶液,需水的质量最多的是甲
D. 升高丙溶液的温度,一定有晶体析出
32. 某白色粉末状固体甲,可能含有硫酸钠、氢氧化钠、碳酸钠、氯化钠;某溶液乙可能含有硝酸钡、氯化钠。为探究它们的成分,某化学小组开展了下图所示的实验。
请回答下列问题:
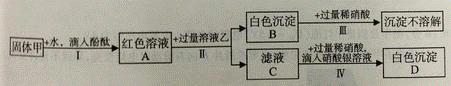
16、溶液A呈_______(填“酸性”、“中性”、“碱性”)。步骤Ⅱ中分离混合物的方法是_______
17、固体甲中一定含有的物质是_________________,滤液C中除了指示剂外还含有的溶质是_____________
18、根据步骤Ⅳ不能确定固体甲中某物质一定存在,其理由是_______________。要证明甲中该物质的存在,需补充的实验操作是______________ __________,观察现象。
__________,观察现象。
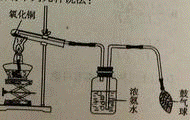
37. 某化学小组成功完成了下图所示实验(装置气密性良好),验证了二氧化碳的组成。
探究过程如下:
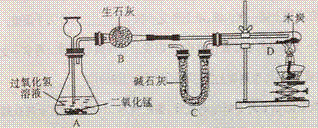
1. 称量装有干燥块状木炭的试管D,质量为50.7g ,装有碱石灰的装置C质量为112.3g,连接A、B、D装置;
,装有碱石灰的装置C质量为112.3g,连接A、B、D装置;
2. 从长颈漏斗加入足量3%的过氧化氢溶液,连接C装置,点燃酒精灯;
3. 待D中发生反应,熄灭酒精灯,冷却;
待D中发生反应,熄灭酒精灯,冷却;
4. 称量试管D及剩余固体的质量为50.1g,装置C的质量为114.5g
已知:碱石灰的成分是氧化钙和氢氧化钠,木炭中的杂质不参与反应,B、C中所装药品足量,能完全吸收相关物质。请回答下列问题:
A. 装置A反应的化学方程式为_____________________,该反应属于_________反应
B. 酒精灯加热的作用是_____________________
C. 为减小误差,步骤Ⅲ冷却过程中需要注意的问题是__ _____________________
_____________________
D. 根据实验数据计算参加反应的氧气的质量为(列式并计算)_____________,从而计算出二氧化碳中碳、氧元素的质量比。
34. 实验室新进一批块状大理石。某化学小组成员称量12.5g该大理石样品,加入足量稀盐酸测定碳酸钙的含量。完全反应后,承德固 体剩余的质量为2.5g。样品中杂质不溶于水且不与稀盐酸反应,请回答下列问题:
体剩余的质量为2.5g。样品中杂质不溶于水且不与稀盐酸反应,请回答下列问题:
(1) 该样品中碳酸钙的质量为__________
(2) 计算12.5g该样品最多可制得二氧化 碳的质量,写出必要的计算过程。
碳的质量,写出必要的计算过程。


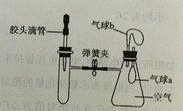 胶头滴管内物质
胶头滴管内物质
