(单词翻译:单击)
一、单项选择题(本题共20小题,每小题2分,共40分)
1.下列变化中,都属于物理变化的一组是( )
A.铁器生锈 水果腐烂 B.水的蒸发 水的电解
C.石蜡融化 石蜡燃烧 D.胆矾研碎 汽油挥发

考点:化学变化和物理变化的判别
2.下列实验基本操作正确的是( )

A.取用锌粒 B.氧气验满 C.滴加液体 D. 读取液体体积

3.如图是小莫家使用的化肥包装袋上的部分说明,该化肥属于( )

A.氮肥 B.磷肥 C.钾肥 D.复合肥

4.含有氯元素的酸有多种,高氯酸(HClO4)中氯元素的化合价是( )
A.﹣1 B![]() .+3 C.+5 D.+7
.+3 C.+5 D.+7

5.生活中下列做法不科学的是( )
A.聚氯乙烯薄膜用于食品包装
B.尽量不选择合成纤维类材料缝制贴身衣服
C.洗涤剂作乳化剂,用来清除油污
D.食用“加铁酱油”可预防缺铁性贫血

6.每年春天,贺州市富川县的脐橙果树开花了,果园周围弥漫着浓郁的花香,这一现象说明( )
A.分子很小 B.分子在不停地运动
C.分子分裂成原子 D.分子之间有间隔

7.镁带在耐高温的密闭容器中(内含空气)加热发生反应3Mg+N2 Mg3N2,下列图中能正确表示容器里所盛物质总质量变化的是( )
Mg3N2,下列图中能正确表示容器里所盛物质总质量变化的是( )


8.下列日常生活有利于环境保护的是( )
A.随意丢弃废旧电池 B. 提倡使用一次性木筷
C.使用无磷洗衣粉 D. 经常用除草剂除草
【答案】 C
【解析】

9.化学是一门以实验为基础的科学,下列对有关实验现象描述正确的是( )
A.硫在空气中燃烧,发出蓝紫色火焰
B.硫酸硐溶液与氢氧化钠溶液反应,有蓝色沉淀产生
C.铁丝在空气中剧烈燃烧,火星四射,生成黑色固体
D.红磷在空气中燃烧,产生大量的白雾

10.下列关于营养与![]() 健康的说法错误的是( )
健康的说法错误的是( )
A.人摄取维生素不足,不会患营养![]() 缺乏症 B.如果蛋白质摄入量不足,会使人生长迟缓
缺乏症 B.如果蛋白质摄入量不足,会使人生长迟缓
C.人体内的脂肪储备着丰富的能量 D.食盐添加适量碘酸钾,补充人体所需的碘

11.下列各组物质是按氧化物、单质、混合物进行分类的是( )
A.干冰 钢 ![]() 空气 B.冰 金刚石 矿泉水
空气 B.冰 金刚石 矿泉水
C.酒精 生石灰 过磷酸钙 D.五氧化二碳 铁 冰水共存物
【答案】B
【解析】

12.生活中的下列物质pH值大于7的是( )
A.牙膏 B.厕所清洁剂 C.生理盐水 D.苹果

13![]() .创建无烟校园,人人有责,吸烟有害健康,香烟的烟气中含有的尼古丁(化学式C10H14N2)对人体危害很大,下列有关尼古丁的说法错误的是( )
.创建无烟校园,人人有责,吸烟有害健康,香烟的烟气中含有的尼古丁(化学式C10H14N2)对人体危害很大,下列有关尼古丁的说法错误的是( )
A.尼古丁由C、H、N三种元素组成
B.尼古丁中氮元素的质量分数约为23.1%
C.尼古丁是有机物
D.尼古丁中C、H、N三种元素质量比为60:7:14

14.在反应A+B=C+D中,20g A和10g B恰好完全反应,生成5g C,若要制得5g D,则需要B的质量为( )
A.5g B. 4g C.2g D.3g

15.下列除去杂质的方法中,合理的是( )
选项 | 物质 | 杂质 | 除杂方法 |
A | CO2 | 水蒸气 | 通入浓硫酸中 |
B | NaCl溶液 | NaOH溶液 | 加入适量BaCl2溶液,过滤 |
C | 铁粉 | 铜粉 | 加入足量的稀硫酸,过滤 |
D | CaO | CaCO3 | 加入适量稀盐酸,过滤 |
A.A B.B C.C D.D

考点:物质除杂或净化的探究;常见气体的检验与除杂方法;金属的化学性质;碱的化学性质;盐的化学性质.
16.下列化学方程式的基本反应类型,其中一个与众不同的是( )
A.2H2O 2H2↑+O2↑ B.2KMnO4
2H2↑+O2↑ B.2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C.C2H5OH+3O2 2CO2+3H2O D.Ca(HCO3)2
2CO2+3H2O D.Ca(HCO3)2 CaCO3
CaCO3![]() +CO2↑+H2O
+CO2↑+H2O![]()

17.如图是金属活动性顺序表的一部分,括号里对应的金属应该是( )
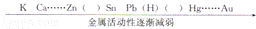
A.Al Cu B.Al Fe C. Mg Fe D. Fe Cu
18.区分下列各组物质,所加试剂或操作方法错误的是( )
选项 | 待区分的物质 | 鉴别方法 |
A | 合成纤维和纯羊毛 | 分别 |
B | CaCl2溶液和NaCl溶液 | 分别取少量溶液,加硝酸银溶液,观察现象 |
C | 酒精和水 | 闻气味 |
D | 碳粉和氧化铜 | 分别取少量加入稀硫酸,观察现象 |
A.A B.B C.C D.D
【答案】B
【解析】
试题分析:A、羊毛主要成分是蛋白质,燃烧后发出烧焦羽毛的味道;而合成纤维没有这种味道,故方法正确; B、氯化钙和氯化钠中都含有氯离子,都能够和硝酸银反应产生沉淀,现象相同,故方法错误; C、酒精有特殊的香味,白醋有酸味,故方法正确; D、硫酸能够和氧化铜反应,溶液变成![]() 蓝色,而碳不反应,故方法正确;故选项为:B
蓝色,而碳不反应,故方法正确;故选项为:B
考点:物质的鉴别、推断;酸的化学性质;盐的化学性质;化学性质与物理性质的差别及应用;棉纤维、羊毛纤维和合成纤维的鉴别.
19.以下四组离子,有一组能大量共存且能形成无色透明溶液,它应该是( )
A.Fe3+ ![]() SO42﹣ H+ Cl﹣ B.Mg2+ Cl﹣ OH﹣ Na+
SO42﹣ H+ Cl﹣ B.Mg2+ Cl﹣ OH﹣ Na+
C.H+ Ba2+ NO3﹣ SO42﹣ D.H+ Na+ K+ NO3+

20.如图是稀HCl和NaOH溶液反应的pH变化曲线图,![]() 据图分析能得出的结论正确的是( )
据图分析能得出的结论正确的是( )
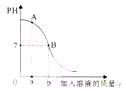
A.该反应是NaOH溶液滴入稀盐酸
B.a克是指加入NaOH溶液的质量
C.A点时,溶液的溶质为NaOH、NaCl
D.B点表示稀盐酸和加入的NaOH溶液质量一定相同
【答案】C
【解析】

二、填空题(共5小题,每个化学方程式2分,其余每空1分,共26分)
21.(4分)用化学用语填空:
(1)单质硅________; (2)化学实验室最常用的溶剂______;
(3)氨分子______; (4)氧化铁中铁元素的化合价______.

22.(7分)化学与我们的日常生活紧密相关,现有①石墨 ②氮气 ③盐酸 ④钛合金 ⑤3%﹣5%的碳酸氢钠溶液 ⑥葡萄糖 ⑦硫酸铜 ⑧醋酸 ⑨氢气等物质,请按要求用序号填空:
(1)不慎将浓硫酸粘到皮肤或衣服上,应立即用大量的水冲洗,然后再涂上______;
(2)农业上用石灰乳和______等配制成![]() 具有杀菌作用的波尔多液;
具有杀菌作用的波尔多液;
(3)可作为人体重要能量来源的是______; (4)能导电,可作为电极的是______;
(5)与人体具有很好“相容性”,可用来制造人造骨的是 ______;
(6)人体胃液中主要的酸是______; (7)食品包装袋内填充的保护气是______.

23.(4分)如图1是钠原子的结构示意图,结合图形回答下列问题: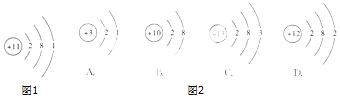
(1)在化学反应中,钠原子一般易______(填“得到”或“失去”)电子,形成 (填“阳”或“阴”)![]() 离子.
离子.
(2)该元素在化合物中的化合价为______价.
(3)钠原子与图2哪种原子化学性质相似______(填选项).

24.(4分)如图是![]() 甲、乙两种固体物质的溶解度曲线,根据图回答问题:
甲、乙两种固体物质的溶解度曲线,根据图回答问题:

(1)t1℃时,甲、乙两种物质的溶解度甲______乙(填“>”、“=”或“<”).
(2)若想从甲的饱和溶液中获得甲晶体,常采用______方法.
(3)t2℃时,将15克甲放入装有50克水的烧杯中,所得溶液溶质的质量分数为______.
(4)A点状态中乙溶液属于______溶液(填“饱和”或“不饱和”).

25.(![]() 7分)(1)归纳与比较,是学习化学的重要方法之一,对比CO和CO2,它们的组成元素________,但它们的化学性质________,工业上CO可用来冶炼金属,是利用它的________性.
7分)(1)归纳与比较,是学习化学的重要方法之一,对比CO和CO2,它们的组成元素________,但它们的化学性质________,工业上CO可用来冶炼金属,是利用它的________性.
(2)铝具有良好的抗腐蚀性,是由于铝在空气中与氧气反应,在其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化,铝与氧气反应的化学方程式为________.
(3)进入森林,注意防火,通常状况下燃烧需要三个条件:①可燃物 ②氧气(或空气) ③
________;当森林发生火灾时,将大火蔓延路线前的一片树木砍掉,形成隔离带,其灭火原理是________.

三、简答题(共2小题,每个化学方程式2分,其余每空1分,共12分)
26.(![]() 6分)(1)随着全球能源使用量的增长,化石能源将日趋枯竭,农村新建沼气池可以部分解决农村燃料问题,沼气的主要成分是甲烷,甲烷燃烧的化学方程式为________.
6分)(1)随着全球能源使用量的增长,化石能源将日趋枯竭,农村新建沼气池可以部分解决农村燃料问题,沼气的主要成分是甲烷,甲烷燃烧的化学方程式为________.
(2)近几年来,有些人在贺江非法挖沙,河床被破坏,河水浑浊,部分人还往江边倒垃圾,造成贺江水严重污染,结合你学过的知识,提出保护贺江水的两点建议:a________、b________;经有关部![]() 门大力整治后,贺江水质已经有所好转,要想知道贺江水是硬水还是软水,可以用________检验,生活中的硬水经过
门大力整治后,贺江水质已经有所好转,要想知道贺江水是硬水还是软水,可以用________检验,生活中的硬水经过 ![]() 后可以转化为软水.
后可以转化为软水.

考点:常用燃料的使用与其对环境的影响;硬水与软水;水资源的污染与防治;书写化学方程式、文字表达式、电离方程式.
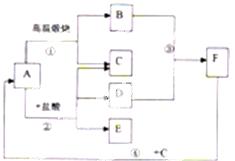
27.(6分)A、B、C、D、E、F为初中化学常见物质,它们之间的转化如图所示,A是固体物质,C是气体,请回答下列问题:
(1)你推测C是________气体.
(2)B、F的化学式分别是________ 、________,写出B物质的一种用途________.
(3)F与C反应的化学方程式为________.

考点:物质的鉴别、推断;化学式的书写及意义;书写化学方程式、文字表达式、电离方程![]() 式
式
四、科学探究题(共2小题,每个化学方程式2分,其余每空1分,共16分)
28.(8分)根据如图回答问题:
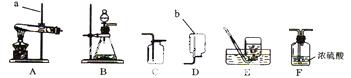
(1)仪器a和b的名称分别是 ________、________.
(2)实验室制取二氧化碳时,可选用的发生装置是________(填字母序号,下同),该装置的优点是________.
(3)实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式为________,二氧化锰在此反应中起________作用,若想用该反应原理制取并收集一瓶干燥的氧气,所选装置的连接顺序是________.

29.(8分)在化学实验探究课上,化学老师交给![]() 化学兴趣小组一包可能含有Na2SO4、NaNO2(亚硝酸钠)、NaCl(至少含有两种物质)的白色粉末,请你和同学们一起参与探究该白色粉末的主要成分.
化学兴趣小组一包可能含有Na2SO4、NaNO2(亚硝酸钠)、NaCl(至少含有两种物质)的白色粉末,请你和同学们一起参与探究该白色粉末的主要成分.
(1)提![]() 出问题:该白色粉末的主要成分是什么?
出问题:该白色粉末的主要成分是什么?
(2)查阅资料
化学式 | 酸碱性 | 与稀盐酸作用 | 毒性 |
NaNO2 | 碱性 | 放出棕红色气体 | 有 |
NaC1 | 中性 | 不反应 | 无 |
(3)提出猜想:
猜想Ⅰ:只含有NaCl、Na2SO4 猜想Ⅱ:只含有NaCl、NaNO2
猜想Ⅲ:只含有________猜想Ⅳ:含有NaCl、Na2SO4、NaNO2
(4)进行探究
步骤 | 实验操作 | 实验现象 | 结论 |
步骤一 | 取少量固体样品于两支试管 | 试管1:溶液变红色 试管2:无明显现象 | 一定有 , 一定没有 . |
步骤二 |
| 有白色沉淀产生 | 一定有 . |
(5)通过实验,猜想________成立.
(6)写出步骤二中发生的化学方程式________.
(7)拓展:粗盐中常含有可溶性和不溶性杂质,粗盐提纯的基本操作步骤是溶解、________、蒸发.

考点:实验探究物质的组成成分以及含量;氯化钠与粗盐提纯;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
五、计算题(共6分)
30.(6分)小英同学为了测定某地区石灰石样品中碳酸钙的质量分数,取该样品15g,现将75mL的稀盐酸分三次加入石灰石样品中,每次充分反应后测得生成气体的质量,实验数据如下表:
实验 | 第一次 | 第二次 | 第三次 |
加入稀盐酸的量/mL | 25 | 25 | 25 |
生成气体的质量/g | 2.2 | m | 1.1 |
试求:
(1)m的值是________g.
(2)求该样品中碳酸钙的质量分数(保留一位小数).




