(单词翻译:单击)
一、选择题(本大题包括14小题,每小题2分,共28分。在每小题列出的四个选项中,只有一个是正确的。请将答题卡上对应题目所选的选项涂黑)
1.下列资源的利用过程 中发生了化学变化的是
中发生了化学变化的是
A.铁矿炼铁 B.干冰制冷 C. 海水晒盐 D.风能发电
2.下列场所挂的图标与“消防安全”不相符的是

A.液化气站B.煤矿的井下通道C.农产品批发市场 D.电影院等娱乐场所
3.下列说法正确的是
A.玻璃钢和碳纤维 是天然材料 B.钢铁在海水中不易锈蚀
是天然材料 B.钢铁在海水中不易锈蚀
C.白 色物质造成的污染称为白色污染 D.用灼烧的方法区别棉花和羊毛
色物质造成的污染称为白色污染 D.用灼烧的方法区别棉花和羊毛
4.下列物质的名称和俗名对应正确的是
A.碳酸钙一纯碱 B.氯化钠一食盐
C.碳酸钠一小苏打D.氧化钙一熟石灰
5.氨气密度比空气小,极易溶于水,以下收集氨气的方法正确的是
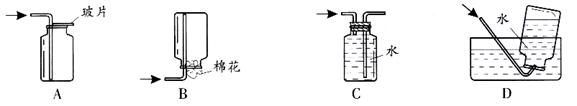
6.下列分类正确的是
A.蒸馏水和矿泉水:硬水 B.生铁和塑料:合成材料
C.金刚行和石墨:碳单质 D.氧化钾和碳酸钾:盐类
7.下列验证实验不能成功的是
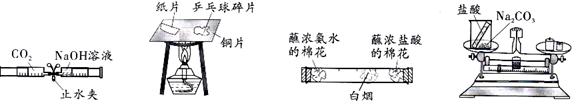
A.C02能与烧碱溶液反应 B.不同物质的着火点不同 C.分子在不断运动 D.质量守
恒定律
8.下列说法正确的是
A.酒精、天然气和石油是化石燃料
B.海洋有大量的水,所以不必珍惜水资源
C.施用农药造成污染,应禁止使用
D.少食蔬菜水果的同学会缺维生素C,有可能引起坏血病
9.右图是某芝麻酱说明书,下列关于该芝麻酱判断正确的是
A.不含微量元素
B.不含糖类和油脂
C.婴儿要慎用
D.钙含量高于蛋白质
| 芝麻酱每100g含有: 蛋白质:19.2g 脂肪:52.7g 糖类:16.8S 维生素A:17ug 铁:50.3mg 硒:4ug 钙:720mg(提醒:可引起部分婴儿过敏性皮炎) |
10.下列实验操作、现象与结论对应关系不正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向食醋中加入氢氧化钠溶液 | 无明显现象 | 二者之间不发生反应 |
B | 向红墨水中加入活性炭,过滤 | 红墨水变五色 | 活性炭具有吸附性 |
C | 用黄铜片在铜片上刻划 | 铜片上有划痕 | 黄铜的硬度比铜大 |
D | 电解水 | 电极上有气泡产生 | 水电解有气体生成 |
11.题11图是R原子结构示意图和磷元素的相关信息,下列说法错误的是
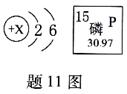
A.X=8
B.磷元素的相对原子质量为15
C.两种元素可形成化学式为P2R5的化合物
D.磷可以在R的单质中剧烈燃烧
12.KCl与KNO3在不同温度的溶解度数据如右表。则下列说法正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 |
KCl | 30g | 33g | 35g | 38g | 41g |
KNO3 | 21g | 31g | 45g | 65g | 88g |
A.丸KNO3比KCl的溶解度大
B.两物质的溶解度相等的温度在20-30℃间
C.在20℃时,10g水中加入5gKCl可得到33.3% 的KCl溶液
D.在50℃时,两物质各5g分别加入l0g水中, 充分溶解,均有固体剩余
13.下列除去杂质(括号内)的方法正确 的是
的是
A.CO(CO2):通过灼热的氧化铜 B NaOH溶液(Na2CO3):加适量稀盐酸
C.NaCl溶液(盐酸):加热蒸发 D.铁粉(氧化铜粉末):加入足量稀硫酸
14.下列图像能正确反映对应的实验操作的是
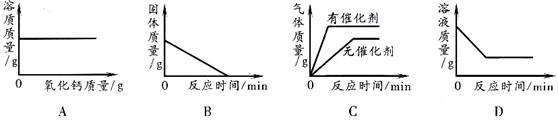
A.向一定量的饱和石灰水中加入氧化钙
B.加热一定量高锰酸钾固体产生氧气
C.用一定量的双氧水制取氧气
D.向一定量的硝酸银溶液中插入铜丝
二、填空题(本大题包括5小题,共21分。请把各题的答案填写在答题卡上)
15.(4分)用化学式填空:最轻气体:________;地壳中含量最高的金属元素:________;
氧化亚铁中铁元素显正二价:________;2个硝酸根离子________。
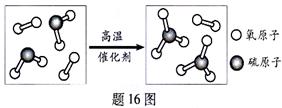
16 .(3分)某反应的微观示意如题16 图。请回答:反应前后的物质中属于单质的名称是 ;该反应的化 学方程式为:_____________。
.(3分)某反应的微观示意如题16 图。请回答:反应前后的物质中属于单质的名称是 ;该反应的化 学方程式为:_____________。
17.(4分)以柴油为燃料的汽车加装尿素箱可使尾气排放达“国四”标准。其工作原理是:
(1)将尿素溶液均匀喷人热的尾气中,并释放出氨气,其反应方程式为:CO(NH2) 2+X=CO2+2N
2+X=CO2+2N H3,则X的化学式为________。
H3,则X的化学式为________。
(2)在催化剂的作用下,氨气使尾气中的氮氧化物快速转化成无害的氮气和水蒸气,水蒸气可吸收尾气中的烟尘,减少PM2.5排放。请写出氨气和N20反应的化学方程式:________。
(3)尿素与熟石灰研磨________(填:“能”、“不能”)产生氨气。
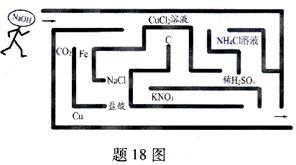
18.(6分)“烧碱同学”要穿过迷宫,从进口顺利地走到出口,途中遇到不反应的物质才能通过。见题18图。
(1)请你在答题卡中用“连续线”画出烧碱应行走的路线。
(2)烧碱在刚进迷宫时,碰到了两种阻止他前进的物质,请写出化学反应的方程式:________、________
19.(4分)点燃不纯的可燃性气体叮能发生爆炸。右下图是某同学的改进装置,请回答:
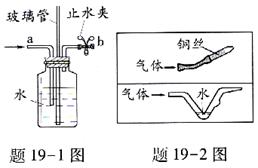
(1)题19-1图是可燃性气体的洗气改进装置,检查它的气密性的方法是:向导管a处 ,
若则气密性好;若在导管a处通人可燃性气体,在导管b处连上尖嘴管并松开止水夹,点燃,即使气体不纯也不会爆炸,可见此装置的作用是________________。
(2)用题19-2图尖嘴管导出可燃性气体并点燃,也不会使管中气体爆炸,其原理是铜丝或水可以
________________。
三、(本大题包括2小题,共15分)
20.(7分)A—E是五种不同类别的常见物质:铁、二氧化碳、氢氧化钙、氯化铜、硫酸中的某种,B常用于中和酸性土壤,E属于酸类。他们之间的相互关系如题20图所示(其中实线表示物质间可以相互反应,虚线表示物质间不能反应)。请回答下列问题:
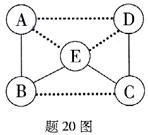
(1)E的化学 式为,B与E反应的化学方程式为:___________,该反应的类型是___________反应。
式为,B与E反应的化学方程式为:___________,该反应的类型是___________反应。
(2)C与D反应的化学方程式为___________。
(3)虚线相邻物质间存在转化关系的是___________→ ___________ (填化学式)。
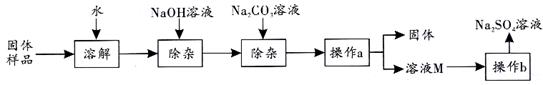
 21.(8分)Na2SO4是制造纸张、药品、染料稀释剂等的重要原料。某Na2SO4样品中含有少量CaCl2和MgCl2,实验室提纯Na2SO4的流程如题21—1图所示。
21.(8分)Na2SO4是制造纸张、药品、染料稀释剂等的重要原料。某Na2SO4样品中含有少量CaCl2和MgCl2,实验室提纯Na2SO4的流程如题21—1图所示。
题21-1图
(1)加入NaOH溶液可除去的阳离子是(填离子符号),其反应的化学方程式为:___________ 。若添加的NaOH溶液和Na2CO3溶液过量,可加入适量___________(填名称)除去。
(2)操作a的名称是 ___________,该操作中需要用到的玻璃仪器有烧杯、玻璃棒、___________ 。
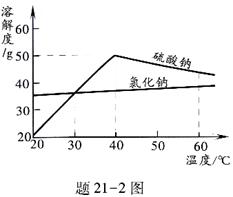
(3)溶液M中的溶质是Na2SO4和杂质NaCl,观察题21—2图的溶解度曲线,则操作b是:先将溶液M 蒸发浓缩,再降温结晶、过滤。降温结晶的最佳温度范围是___________℃以下,因为Na2SO4的溶解度___________ 。
蒸发浓缩,再降温结晶、过滤。降温结晶的最佳温度范围是___________℃以下,因为Na2SO4的溶解度___________ 。
四、(本题包括2小题,共21分)
22,(12分)请根据题22-1图回答相关问题:

A B C D
题22-1图
(1)仪器a的名称是___________。
(2)A图称量前,要将天平调平衡,首先要把___________,然后才调节平衡螺丝;称量粉末状固体时若药品量不足,此时一只手用药匙取药品移至天平左盘上方,另一只手应,使少量药品落人盘中。
(3)上述图有明显错误的是 ___________(填序号 );c图中的玻棒作用是:搅拌,防止 。
);c图中的玻棒作用是:搅拌,防止 。
(4)D图的装置可用来制取的气体是(写—种),制取该气体的化学方程式为:______________________,该装置操作上的优点是______________________。
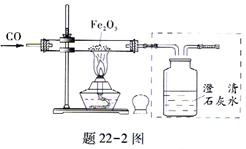
(5)题22-2图是利用CO还原Fe3O4的实验装置图,玻璃管中固体的颜色变化是:___________ ;集气瓶中的溶液用于检验和除去产生的CO2,请把虚框中的图补充完整;处理尾气的方法是___________。
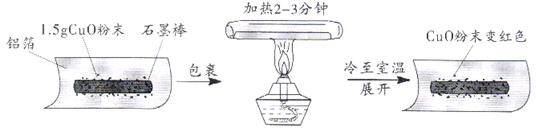
23.(9分)某兴趣小组在做完碳还原氧化铜实验后,进行了题23图所示的探究:
题23图
【猜想】把氧化铜还原成铜的物质是:I.石墨棒;II___________。
【实验】用天平称量1.5g氧化铜粉末,直接用铝箔纸包裹。按上述操作步骤实验,黑色粉末.,那么猜想Ⅱ不成立。
【结论】石墨棒能使氧化铜还原成铜,该反应的化学方程式为___________ 。
【改进】把石墨棒换成铝粉,重复上述操作,又获成功。那么,称取等量的铝粉并进行同样的操作,其目的是___________。改进后的实验证明,金属铝与铜活动性顺序是___________,该反应的化学方程式为 ___________。
___________。
【拓展】如果使用复印机的“碳粉”代替石墨棒还原氧化铜,效果更好。联想在空气中灼热
的铁丝不能燃烧,而铁粉能燃烧,其原因是___________。
五、(本题包括2小题,共15分)
24.(4分)我国民间有端午挂艾草的习俗。艾草含有丰富的黄酮素(化学式为:C15H10O2),有很高的药用价值。请回答:
(1)黄酮素属于化合物(填“有机”或“无机”)。
(2)黄酮素含有 种元素,碳、氢的原子个数比为 (填最简比)。
(3)黄酮素分子中碳元素的质量分数为.(结果精确到0.1%)。
25.(11分)同学们做甲、乙两个中和反应实验的探究(见下图)。
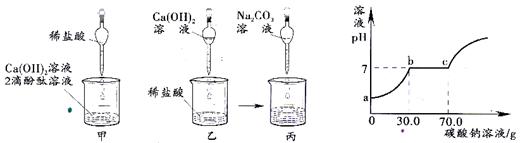
题25-1图题25-2图
(1)甲实验恰好中和,则该溶液中的溶质是 (填化学式)。
(2)取乙反应后的溶液60.0g,滴加质量分数26.5%的Na2C03溶液(见丙图),溶液pH的变化如题25-2图所示。则与CaCl2反应的碳酸钠溶液的质量为 g;请计算该 溶液中CaCl2的溶质质量分数(写出计算过程,精确到0.1%)。
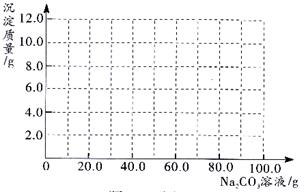
(3)根据计算所得数据在题25-3图中画出产生沉淀的曲线 。
。
(4)乙组的中和反应实验设计存在的不足是 。
题25-3图




