(单词翻译:单击)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.梅州市部分地区特产制作的主要过程中涉及化学变化的是
A.平远脐橙榨汁 B.蕉岭竹笋凉干 C.梅县金柚酿酒 D.五华水柿晒饼
2.下列净化水的操作中,可以降低水的硬度的是
A.过滤 B.蒸馏 C.吸附沉淀 D.静置沉淀
3.有句谚语“每天一个苹果,医生远离我”,苹果主要能为人体提供的营养素是
A.油脂 B.维生素 C.蛋白质 D.无机盐
4.下列说法正确的是
A.分子是化学变化中的最小粒子 B.原子失去电子喉变成阴离子
C.元素间最本质的区别是中子数不同 D.分子、原子、离子都可以直接构成物质
5.人们习惯上把金、银、铜、锡五种金属统称为“五金”。其中金属活动性最强的是
A. 金 B.银 C.铜 D.锡
6.下列说法正确是
A.钢不属于合金 B.金刚石和石墨的性质完全相同
C.铁在潮湿的空气中容易生锈 D.常温下,氧气与所有金属都能反应
7.某化学反应的微观模拟示意图是:
 +
+ 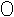
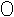

![]()
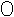 +
+![]()
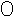 (“
(“  ”表示氢原子,“
”表示氢原子,“ 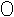 ”,表示氯原子),下列说法错误的是
”,表示氯原子),下列说法错误的是
A.此反应吸收热量此反应为 B.此反应为H2 + Cl2 2HCl
2HCl
C.此反应属于化合反应 D.此 反应前后原子种类不变
反应前后原子种类不变
8.在高速发 展的信息时代,我们要学会获取和辨别信息。下列信息中正确的是
展的信息时代,我们要学会获取和辨别信息。下列信息中正确的是
A.为了提高粮食产量,应大量使用农药、化肥
B.用甲醛水溶液浸泡海鲜产品来延长食品保质期
C.锌元素有“智力之花”美称,补锌口服液喝得越多越好
D.塑料薄膜可用于大棚蔬菜的生产,同时也会造成“白色 污染”
污染”
9.有关燃烧与灭火的说法错误的的是
A.用灯帽盖灭酒精灯——隔绝氧气
B.森林灭火时,建立隔离带——隔绝可燃物
C.家具起火,用水扑灭——降低温度
D.镁条在酒精灯上点燃——提高着火点
10.物质X可发生下列所示的两个反应,则X可能是
①X+碱→盐+水 ②X+金属氧化物→盐+水
A.HCl B.CO C.NaOH D. CaO
二、(本题包括4小题,共34分)
11.(10分)化学与生活息息相关。现有水、氮气、甲烷、硫酸、碳酸钙等五种物质,对应物质的化学式填空:
(1)钟乳石的主要成分是___________
(2)天然气的主要成分是___________
(3)汽车用铅蓄电池中含有的酸是___________
(4)充入食品包装袋内用于防腐的是___________
(5)生命的孕育和维系需要的氧化物是___________
12.(8分)20℃时,分别向盛有10g水的A、B两试管中加入等质量的甲、乙两种固体,充分溶解后,观察到如图1所示的现象。图2表示的是甲、乙两种物质的溶解度曲线。
(1)20℃时___________(填“A”或“B”)试管中的溶液一定是饱和溶液。
(2)图2中___________填“M”或“N”)表示乙物质的溶解度曲线。
(3)要使B试管中剩余固体继续溶解,可采用的方法是________(答一种方法即可)。
(4)将10℃时M的饱和溶液升温到20℃(假设水不蒸发),其溶质的质量分数________(填“增大”、“减小”或“不变”)。
13.(8分)钠元素对人类生命、生产和生活具有重要意义。
(1)钠元素的原子结构示意图为  ,则钠原子的最外层电子数为________。
,则钠原子的最外层电子数为________。
(2)某病人静脉注射需一定量的生理盐水,生理盐水中的溶质是________(写化学式)。
(3)将金属钠与液态氨反应得NaNH2,再将NaNH2与Na2O反应可生成NaN3,反应的化学方程式为2NaNH2 +N2O=NaN3+NaOH+X,则X的化学式________。
(4)盛烧碱溶液的试剂瓶若使用玻璃塞,时间长了能生成Na2SiO3而使瓶塞被黏住。Na2SiO3中Si元素的化合价为________。
14.(8分)某兴趣小组在实验室发现了一块绿色的孔雀石标本,查阅资料知其主要成分是
Cu2 (OH)2 CO3。他们以Cu2 (OH)2 CO3原料制取铜,其工艺流程如下图所示:
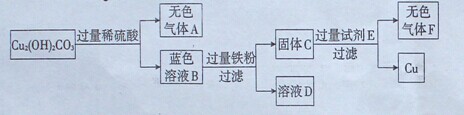
(1)过滤操作中用到的铁制仪器为________。
(2)无色气体A的化学式是________,大气中该气体含量不断上升,会导致________增强,全球气候变暖。
(3)写出蓝色溶液B与铁粉反应的化学方程式________________________
(4)试剂E可选用 ________溶液。
三、(本题包括2小题,共24分)
15.(14分)某学习小组利用下图仪器或装置进行气体制备,回答有关问题:
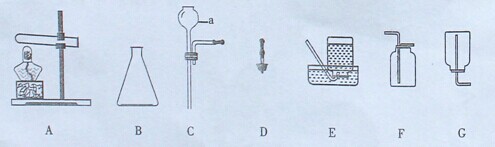
(1)写出仪器a的名称________;用装置A制取氧气的化学方程式为________ 。
。
(2)若要在实验室制取二氧化碳气体,其发生装置可选择图中的________(填序号)进行组装。连接玻璃管和胶皮管的操作:先把玻璃管口________,然后稍稍用力即可把玻璃管插入胶皮管内。
(3)要制得干燥的二氧化碳,可在收集装置前增加盛有________的洗气瓶。
(4)实验室收集氧气和二氧化碳都可用到的装置是________(填序号)。
(5)用澄清石灰水检验二氧化碳,其反应的化学方程式为________________ 。
16.(10分)糕点疏松剂的主要成分中还有碳酸氢钠,某化学兴趣小组对碳酸氢钠的化学幸会进行探究。
【探究实验一】 碳酸氢钠溶液的酸碱性:用PH试纸测得碳酸氢钠溶液的ph约为10。由此得出的结论是碳酸氢钠溶液呈________。
【探究实验二】 碳酸氢钠能否与酸反应:取少量固体放入试管中,滴加足量的稀盐酸,现象为________。结论:碳酸氢钠能与酸反应。
【探究实验三】 碳酸氢钠的热稳定性:取一定量的碳酸氢钠放在铜片上加热,如图所 示。
示。
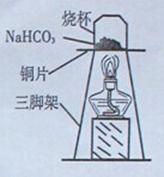
(1)加入一段时间后,观察到烧杯内壁有水珠。
(2)充分加热后,将烧杯迅速倒转过来,加入适量的澄清石灰水,震荡,观察到澄清石灰水变浑浊。
(3)通过进一步实验来确定充分加热后的固体产物的成分。限选试剂及仪器:稀盐酸、氯化钙溶液、澄清石灰水、酚酞溶液、蒸馏水、试管、胶头滴管
序号 | 实验操作 | 预期现象 | 结论 |
①
| 取少量加热后的固体产物放入试管A中,加入适量蒸馏水,充分振荡溶解,滴加足量_________,振荡,静置。 |
产生白色沉淀
|
产物含Na2CO3
|
② | 取操作①后的上层清液于试管B中,滴加_________。 |
_________ |
产物不含NaOH
|
(4)根据上述实验结论,写出碳酸氢钠受热分解的化学方程式。
四、(本题包括1小题,共12分)
17.(12分) 某氢氧化钙中韩碳酸钙杂质。称取研细的该样品12.4g放入锥形瓶中,加入32.6g的水,充分振荡形成悬浊液,再向锥形瓶中逐滴滴加盐酸使其充分反应至无气泡产生。测得加入盐酸的质量与锥形瓶中的物质的质量关系如下表示。
加入盐酸的质量g | 0 | 25 | 37.5 |
锥形瓶中物质的质量 | 45 | 70 | 80.3 |
(1)加入盐酸的质量在0—25g时,___________与盐酸发生反应 。
。
(2)反应产生二氧化碳质量为___________g。
(3)求样品中氢氧化钙的质量分数(写出计算过程,精确到0.1%)。
一、选择题(本题包括10小题,每小题3分,共30分,每 小题只有一个选项符合题意)
小题只有一个选项符合题意)
1.C
2.B
3.B
4.D
5.C
6.A
7.A
8.D
9.D
10.A
二、(本题包括4小题,共34分)
11、(1)CaCO3;(2)CH4;(3)H2SO4;(4)N2;(5)H2O
12.(1) B ;
(2) N
(3) 升高温度 .
(4) 不变 .
13.(1) 1 .
(2) NaCl .
NaCl .
(3) NH3 .
(4) +4 .
14.(1) 铁架台
(2) CO2 , 温 室效应 .
室效应 .
(3) CuSO4+Fe=FeSO4+Cu .
(4) 稀硫酸 .
三、(本题包括2小题,共24分)
解:(1)根据实验室常用仪器的认识,可知仪器a的名称为:长颈漏斗;A装置的特点适用于固 体加热型的反应,适用于高锰酸钾加热制取氧气,反应的方程式为:2K
体加热型的反应,适用于高锰酸钾加热制取氧气,反应的方程式为:2K MnO4
MnO4 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(2)二氧化碳的实验室制法是用稀盐酸与大理石反应来制取,为固体液体常温型,故发生装置可选用图中的BC组合;连接玻璃管和胶皮管的操作:先把玻璃管口用水润湿,然后稍稍用力即可把玻璃管插入胶皮管内;
(3)据浓硫酸具有吸水性,且不与二氧化碳反应,知浓硫酸可用于干燥二氧化碳,故要制的干燥的 二氧化碳,可在收集装置前增加盛有浓硫酸的洗气瓶;
二氧化碳,可在收集装置前增加盛有浓硫酸的洗气瓶;
(4)据氧气和二氧化碳的密度都比空气大,这两种气体的收集都可以用向上排空气法,故实验室收集氧气和二氧化碳都可用到的装置是F;
(5)澄清石灰水检验二氧化碳生成碳酸钙和水,反应的方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.
故答案为:(1)长颈漏斗,2KMnO4 K2MnO4+MnO2+O2↑;(2)BC,用水润湿;(3)浓硫酸;(4)F;(5)CO2+Ca(OH)2═CaCO3↓+H2O.
K2MnO4+MnO2+O2↑;(2)BC,用水润湿;(3)浓硫酸;(4)F;(5)CO2+Ca(OH)2═CaCO3↓+H2O.
16.
解:
实验一:用pH试纸 测得碳酸氢钠
测得碳酸氢钠 溶液的pH为10,大于7,显碱性;
溶液的pH为10,大于7,显碱性;
实验二:碳酸氢钠能够和稀盐酸反应生成碳酸钠、水和二氧化碳气体;
实验三:(3)检验生成物是NaOH还是Na2CO3,加入足量的氯化钙溶液可以与碳酸钠溶液反应产生沉淀的物质,若有白色沉淀生成,说明固体产物是Na2CO3取反应后的上 层清液,
层清液, 向其中滴加酚酞试液,酚酞试液不变红,说明溶液
向其中滴加酚酞试液,酚酞试液不变红,说明溶液 中不含氢氧根,说明固体产物中不含氢氧化钠;
中不含氢氧根,说明固体产物中不含氢氧化钠;
(4)碳酸氢钠受热容易分解,生成水、二氧化碳气体和Na2CO3,反应的化学方程式为:2NaHCO3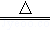 Na2CO3
Na2CO3 +CO2↑+H2O.
+CO2↑+H2O.
故答案为:碱性;产生大量气泡;氯化钙;酚酞溶液;溶液不变色;2NaHCO3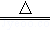 Na2CO3+CO2↑+H2O.
Na2CO3+CO2↑+H2O.
四、(本题包括1小题,共12分)
17.
解:(1)加入盐酸的质量在0﹣25g时,反应前后物质质量不变,说明是氢氧化钙和稀盐酸反应.
故填:氢氧化钙.
(2)反应产生二氧化碳的质量为:12.4g+32.6g+37.5g﹣80.3g=2.2g,
故填:2.2.
(3)设碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 2.2g
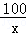 =
=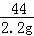 ,
,
x=5g,
样品中氢氧化钙的质量分数为: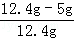 ×100%=
×100%= 59.7%,
59.7%,
答:样品中氢氧化钙的质量分数为59.7%.


