(单词翻译:单击)
试卷真题
第Ⅰ卷(选择题 共36分)
选择题(本大题共12个小题,每小题3分;每小题只有一个选项符合题意,多选、错选均不给分。)
1.下列物质的性质中,属于物理性质的是
A.稳定性 B.酸碱性 C.还原性 D.挥发性
2.下列含有“水”的物质中,属于纯净物的是
A.硬水  B.蒸馏水 C.矿泉水
B.蒸馏水 C.矿泉水  D.自来水
D.自来水
3.将塑料袋密封良好的方便面从平原带到高原时,塑料袋鼓起,是因为袋内的气体分子
A.质量增大 B.个数增多 C.间隔增大 D.体积增大
4.衣服上沾有碘很难洗净,碘在下列四种不同溶剂中的溶解性如下表所示:
溶质 | 碘 | |||
溶剂 | 水 | 酒精 | 汽油 | 苯(有毒) |
溶解性 | 微溶 | 可溶 | 易溶 | 易溶 |
由表中提供的信息判断,洗净衣服上的碘污渍的最佳选择是
A.水 B.酒精  C.汽油 D.苯
C.汽油 D.苯
5.下列化学符号中的数字表示的意义不正确的是
A.NO2:“2”表示一个二氧化氮分子含有两个氧原子
B.2Na:“2”表示两个钠元素
C.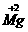 :“+2”表示镁元素的化合价为+2价
:“+2”表示镁元素的化合价为+2价
D.2O H-:“2”表示两个氢氧根离子
H-:“2”表示两个氢氧根离子
6.粒子M通过一定方式转化为N, 如右图所示:
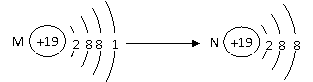
变化前后保持不变的是
A.核电荷数 B.带电情况 C.化合价 D.化学性质
7.下列物质加入水中,所得溶液pH可能为10的是
A.生石灰 B.白醋 C.桔子汁 D.食盐
8.偏钛酸钡(BaTiOx)因其显著的“压电效应”而广泛应用于超声波发生装置中。已知偏钛酸钡中钛元素的化合价为+4价,则其化学式中x的数值是
A.1 B.2 C.3 D.4
9.下列物质的用途与性质不对应的是
A.食品包装中充氮气以防腐——常温下氮气的化学性质不活泼
B.一氧化碳用于冶炼金属——一氧化碳具有可燃性
C.稀有气体能制成多种用途的电光源——稀有气体在通电时发出不同颜色的光
D.干冰可用做制冷剂—— 干冰升华吸热
10.下列对有关主题知识的归纳错误的是
A.安全常识 室内煤气泄漏——立即打开排风扇 浓硫酸沾到到皮肤上——立即用水清洗 | B.元素与人体健康 人体缺铁——易引起贫血 人体缺氟——易产生龋齿 |
C.生活常识 洗涤剂洗去油污——乳化作用 煤炉取暖防中毒——开窗通风 | D.环保与物质的利用 减少白色污染——使用可降解塑料 减少汽车尾气污染——使用乙醇汽油 |
11.右图是A、B、C三种固体物质的溶解度曲线。下列说法错误的是
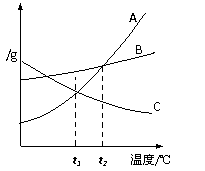
A.物质 A的溶解度随温度的升高而增大
A的溶解度随温度的升高而增大
B.t1℃时,物质B的溶解度大于物质A的溶解度
C.t1℃时,物质A和物质C的溶解度相等
D.将t2℃时的物质C的饱和溶液降温到t1℃时,溶液依然饱和
12.镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式为La2O3,La(OH)3是不溶于水的碱,而LaCl3、La(NO3)3都可溶于水。由此判断下列几组物质,不能直接反应制取LaCl3的是
A.La(OH)3和 HCl B .La2O3 和 HCl
.La2O3 和 HCl
C.La 和 HCl D.NaCl 和 La(OH)3
第Ⅱ卷(非选择题 共54分)
13、(5分)化学材料的发展和应用,推动了社会的进步。铁、铝、铜合金、棉花、塑料等都是人们生活和生产中常见的材料。
(1)上述材料中,属于天然有机材料的是______ ;属于合成有机材料的是______ 。
(2)铁和铝能制成铁锅、铝锅等生活中常用的炊具。铁锅容易生锈,是因为与空气中的
和______ 反应;而铝锅表面易形成一层致密 (写化学式)薄膜,使铝锅不易生锈,阻止铝进一步氧化。
14、(4分)大米是我们餐桌上的主食,含淀粉约80%。
(1)大米主要为我们提供的营养素是______ 。
(2)某些地区因为工业污染使当地生产的大米含有超标的有毒元素镉,对人体的肺和肾脏等造成损害。镉属于 (填“金属”或“非金属”)元素。
(3)为了提高大米产量,种植过程中需要施用适量的化肥。下列化肥属于复合肥料的是 。
A、Ca3(PO4)2 B、NH4HCO3 C、NH4H2PO4 D、KCl
15、(6分)燃烧是人类最早利用的化学反应之一。
(1)下面是一些常用的灭火方法的事例:
①熄灭酒精灯时,用灯帽盖灭;
 ②熄灭燃气灶火焰时,关闭阀门;
②熄灭燃气灶火焰时,关闭阀门;
③油锅着火时,用锅盖盖灭;
④森林着火时,将大火蔓延线路前的一片树木砍掉;
⑤房屋着火时,用高压水枪灭火。
请你从灭火原理角度,选择一种分类标准进行分类:
分类标准______ 包括事例______ (填序号)
(2)打火机中常用丁烷(C4H10)做燃料,丁烷与甲烷完全燃烧产物相同,请写出丁烷完全燃烧的化学方程式______ 。
16.(11分)硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO等,工艺流程简化示意图如下:

根据上图回答下列问题:
(1)将菱锌矿研磨成粉的目的是 _____。
_____。
(2)针铁矿(Goethite)是以德国诗人歌德(Go ethe)名字命名的,组成元素是Fe、O和H,相对分子质量是89,针铁矿中铁原子数︰氧原子数︰氢原子数=______。
ethe)名字命名的,组成元素是Fe、O和H,相对分子质量是89,针铁矿中铁原子数︰氧原子数︰氢原子数=______。
(3)请写出氢氧化锌和稀硫酸反应的化学方程式____________________________。该反应的基本类型是______
(4)“滤液3”之前 加入锌粉的目的是______________
加入锌粉的目的是______________
(5)“滤液3”之后的操作依次为______、干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________×100%。
17.(9分) 登山运动员常利用氢化钙固体作为能源提供剂,在需要时与水反应生成其他物质和氢气,提供燃料。某兴趣小组用纯净干燥的氢气和金属钙制取氢化钙,所选装置图如下:

A B C D E
查阅资料:
(1)钙易与水反应生成碱和气体。
(2)无水氯化钙能作干燥剂。
(1)请写出E图中仪器①的名称______ 。
(2) 请按气流方向连接顺序i接( ),( )接( ),( )接( ),k接 a
(填仪器接口的字母编号)。写出C中可能发生的化学方程式______ 。
(3)实验结束后,某同学取少量生成物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色。该同学据此判断,上述实验的确有CaH2生成。另一位同学认为该同学的判断不准确,原因是______ 。
(4)氢化钙作为能源提供剂,与直接用氢气相比,其优点是______
18.(11分)现甲、乙两化学小组安装两套如下相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素。
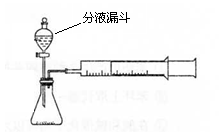
(1) 下列方法能检查该装置气密性的是______。
A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差。
B、关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差。
C、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差。
(2)MnO2催化下H2O2分解的化学方程式是_________。
(3) 甲小组有如下实验设计方案,完成下表。
实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
甲组实验Ⅰ | 探究 对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%H2O2 |
甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
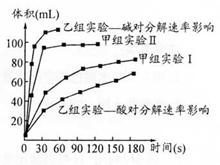
⑷甲、乙两小组得出如图数据。
①甲组实验得出的数据可知:浓度越大,H2O2分解速率_________;
②由乙组研究的酸、碱对H2O2分解影响因素的 数据分析:相同条件下, H2O2在_________(填“酸”或“碱”)性环境下放出气体速率较快;乙组提出可以用Ba02固体与硫酸溶液反应制H202(已知还生成另一种物质),其化学反应方程式为 ;支持这一方案的理由是_________。
19、(8分)某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分别用不同的方法进行测定。
实验设计:
甲组:取纯净碳酸钙粉末5g于烧杯中,加入20g该盐酸溶液,充分反应后,过滤、洗涤、干燥,称量得剩余固体3g。
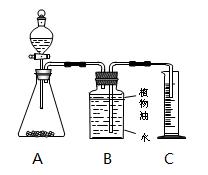
乙组:取纯 净碳酸钙粉末5g于锥形瓶中,将20g该盐酸溶液加入分液漏斗,利用测定产生二氧化碳的体积(20℃、标准大气压)计算盐酸浓度。装
净碳酸钙粉末5g于锥形瓶中,将20g该盐酸溶液加入分液漏斗,利用测定产生二氧化碳的体积(20℃、标准大气压)计算盐酸浓度。装 置示意图如下:
置示意图如下:
数据处理:
(1)请利用甲组数据计算该盐酸的溶质质量分数。(写出计算过程)
(2)乙组计算结果略小于甲组。经过多次实验仍得到相同结果(忽略量筒引起的误差),可能的原因是_________
试题答案
雅安市2014年初中毕业暨高中阶段教育学校招生考试
化学试题参考答案及评分标准
本次阅卷过程中:
(1)化学专用名词、化学式书写错误相应给分点不给分。
(2)化学方程式未配平,相应化学方程式不给分。书写化学方程式时,必要的反应条件未写或写错误,要适当扣分。
(3)除提供的答案外,其它合理 的回答也参考给分。
的回答也参考给分。
第Ⅰ卷
选择题(本大题共12个小题,每小题3分;每小题只有一个选项符合题意,多选、错选均不给分。)
1 D、 2 B、 3 C、 4 C、 5 B、 6 A、 7 A、 8 C、 9 B、 10 A、 11 D、 12 D
第Ⅱ卷
13、(共5分)
(1)棉花; 塑料(2分,每空1分)
(2)水(或H2O) 氧气(或O2); Al2O3(3分,每空 1分)
1分)
14、(共4分)
(1)糖或糖类(1分) (2)金属(1分) (3)C (2分)
15、(共6分)
(1) 隔离可燃物 (2分) ②④ (2分,答对一个给1分,有错不给分,下同)
或隔绝空气 ①③
或降低温度到着火点以下 ⑤
 (2)2C4H10+ 13O2 10H2O+8CO2 (2分)
(2)2C4H10+ 13O2 10H2O+8CO2 (2分)
16、(共11分)
(1)菱锌矿粉与盐酸充分反应(1分);
(2)1:2:1(2分);
(3)Zn(OH)2 +H2SO4= ZnSO4+2H2O(2分);复分解(1分);
(4)除去剩余的硫酸(2分);
(5)蒸发或蒸发结晶(1分);
(6)25m2/13m1或125m2/65m1 (2分)
17、(共9分)
(1)铁架台(1分);
(2)e,f接d,c接j(2分);AgNO3 + HCl= AgCl↓+ HNO3(2分)
(3)钙与水反应也能生成碱,同时也有气泡冒出 (2分,合理答案也给分);
(4)便于携带;安全;通过反应,能将水中的氢元素部分转化为氢气(2分,答出任何一点均给分,合理答案也给分)
18、(共11分)
(1)AB(2分,每答对1个给1分,有错不给分);
(2)2H2O2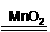 2H2O+O2↑(2分);
2H2O+O2↑(2分);
(3)浓度(1分);
(4)①越快(1分);
②碱(1分);
BaO2 +H2SO4= BaSO4 ↓+H2O2(2分);
过氧化氢在酸性环境下分解较慢(2分)
19、(共8分)
(1)计算过程
解:设参加反应的HCl质量为x ,消耗碳酸钙质量为5g-3g=2g
2HCl+CaCO3=CaCl2+H2O +CO2↑ .............2分
+CO2↑ .............2分
73 100
x 2g ……….1分
73/x=100/2g
X=1.46g ………1分
盐酸的溶质质量分数为:1.46g/20g×100%=7.3% ...............1 分
答:盐酸的溶质质量分数为7.3%。 ...............设、答共1分
(2)测量的水的体积小于生成气体的体积; B、C之间的导管内实验前无水,实验后有水;内外气压相同时,二氧化碳无法将相应体积的水压入量筒;二氧化碳可能溶解在A中反应后的溶液中。(2分)(合理答案均给分)


