(单词翻译:单击)
一、选择题(本大题包括7小题,每小题3分,共21分;每小题只有一个选项符合题意)
1.下列关于能源、资源的说法不正确的是
A.开发新能源汽车可减少汽油、柴油的使用,从而减少雾霾天气现象
B.太阳能、风能发电是今后新能源开发的方向
C.煤、石油、天然气属于化石能源,取之不尽,用之不竭
D.给钢铁制品进行防锈处理,不仅可节约资源,而且可以减少对环境的污染
2.下列实验操作正确的是
|
|
|
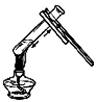 |
A | B | C | D |
3.对下列常见物质分类,正确的是
①食盐水 ②金属铝 ③生石灰 ④烧碱 ⑤盐酸 ⑥纯碱 ⑦水 ⑧石墨
A.属于纯净物的是②④⑤⑥⑦⑧ B.属于单质的是②⑧
C.属于碱的是④⑥ D.属于氧化物的是③④⑥⑦
4.某元素X的原子结构示意图为: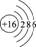 ,下列有关说法正确的是
,下列有关说法正确的是
A.元素X在周期表中的原子序数为16
B.X属于金属元素
C.X与氢形成化合物时,X原子得到电子形成X2-
D.X的原子不能直接构成物质
5.草酸是“消字灵”的主要成分之一,其分子构成如下图。下列关于草酸的叙述不正确的是
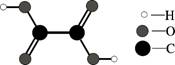
A.草酸属于有机物
B.草酸的化学式为H2C2O4
C.草酸由2个氢原子、2个碳原子、4个氧原子组成
D.草酸的相对分子质量为90
6.下列化学方程式表示的反应正确的是
A.2KNO3 +MgCl2=2KCl+Mg(NO3)2 B.H2SO4+Ba(OH)2=BaSO4↓+2H2O
+MgCl2=2KCl+Mg(NO3)2 B.H2SO4+Ba(OH)2=BaSO4↓+2H2O
C.PbSO4+Cu=CuSO4+Pb D.2Fe+6HCl=2FeCl3+3H2↑
7.下列方法一定能够达到实验目的的是
A.除去氧化铜中含有的木炭粉——高温加热
B.除去碳酸钠中含有少量的碳酸氢钠——加入稀硫酸
C.提纯新制二氧化碳气体(含有少量氯化氢气体)——将气体通过氢氧化钠溶液
D.鉴别生石灰中是否含有未分解的石灰石——加入稀盐酸
二、填空题(本大题包括6小题,共24分)
8.(4分)根据要求填空:
(1)化学式为NaHCO3的物质俗称为 :_____。
:_____。
(2)最简单有机物的化学式为:_____。
(3)“庄稼一支花,全靠肥当家”。化学肥料提供农作物所需的主要三种营养元素为:_____。
(4)空气中含量最大的氮气约占空气总体积的_____。
9.(3分)化学与生活生产有着紧密联系。“佝偻病”是因为人体缺少_____元素造成的;建筑上应用较多的钢材,其钢的性能比纯铁优良,因为它是铁和一定量的碳及少量其它元素形成的_____;塑料食品包装袋的材料为(选填序号):_____。
①天然高分子材料 ②有机合成材料 ③无机非金属材料 ④功能复合材料 ⑤金属材料
10.(3分)常见的燃烧是指_____与氧气发生的一种发光、发热的剧烈的氧化反应。图书着火可用干粉灭火器灭火,其干粉主要成分为碳酸氢钠,灭火时发生的反应为:2NaHCO3=Na2CO3+CO2↑+H2O,从灭火原理说明该反应的作用:_____;该反应的基本反应类型为:_____。
11.(3分)2011年云南曲靖的铬(Cr)污染事件,说明含铬废渣(废液)的随意排放对人类生存环境有极大的危害。电解法是处理铬污染的一种方法,其处理过程发生的反应可表示为:
6Fe+K2Cr2O7+H2SO4+17H2O = 6Fe(OH)3↓+2Cr(OH)3↓+6X+K2SO4
(1)K2Cr2O7中Cr元素的化合价为_____。
(2)物质X的化学式为_____。
(3)实验室收集X时,可用向下排空气法,则利用了X____的物理性质。
12.(5 分)实验室配制氯化铵(NH4Cl)溶液不能使用硬水,因硬水中含有较多的____。氯化铵的溶解度曲线如图所示。
分)实验室配制氯化铵(NH4Cl)溶液不能使用硬水,因硬水中含有较多的____。氯化铵的溶解度曲线如图所示。
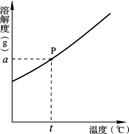
(1)曲线上P点表示(选填序号):_____。
① t ℃时,100 g水中溶解了氯化铵a g
② t ℃时,100 g溶液中含有氯化铵a g
③ 100 g水中最多只能溶解氯化铵a g
④ t ℃时,100 g水中最多只能溶解氯化铵a g
(2)用pH试纸测试无色氯化铵溶液,测得pH<7,则氯化铵溶液显____性;若向该溶液中滴加无色酚酞试液,则溶液显示_____色。
(3)t ℃时的氯化铵饱和溶液的溶质质量分数为:_____。
13.(6分)硫酸工业的部分生产流程如图:
SO2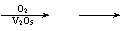 SO3
SO3  H2SO4
H2SO4
某硫酸生产厂以黄铁矿(主要成分为FeS2)为原料生产硫酸,首先将矿石粉吹入沸腾炉里燃烧,制得SO2,其反应可表示为:□FeS2+□O2=□Fe2O3+□SO2。
(1)配平矿石粉在沸腾炉中燃烧的反应方程式。
(2)若以SO2为原料生产硫酸,其过程中的反应均为化合反应,写出其反 应的化学方程式:
应的化学方程式:
SO2→SO3 :____; SO3+( )→H2SO4:_____
:____; SO3+( )→H2SO4:_____ 。
。
(3)SO2→SO3的反应过程中,V2O5的作用是:_____。
(4)沸腾炉的炉渣主要成分为Fe2O3,可变废为宝用于炼铁。写出高炉炼铁主要反应的化学方程式:____。
(5)市售硫酸多为98%的浓硫酸,实验室常将浓硫酸稀释成稀硫酸使用。稀释操作时,必须将____,否则会造成危险。
三、实验与探究题(本大题包括2小题,共10分)
14.(4分)根据实验要求完成下列各题:
(1)实验室通常用(填写化学方程式)____反应制O2 ;如图所示的实验装置中,可用作O2制气装置的是(选填字母)____。
(2)粗盐中难溶性杂质的去除实验的基本操作步骤依次为:________、________、________ ;最后一步操作中需要用到的仪器有(选填字母):____。
a.玻璃棒  b.试管 c.酒精灯 d.蒸发皿 e.
b.试管 c.酒精灯 d.蒸发皿 e. 量筒 f.烧杯 g.铁架台
量筒 f.烧杯 g.铁架台
15.(6分)乙炔(化学式为C2H2)是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转 化成多种化合物。乙炔气体和氧气反应能产生高温火焰(氧炔焰),工人师傅常用氧炔焰切割或焊接金属构件。现在让我们一起对乙炔燃烧(氧炔焰)的产物进行探究。
化成多种化合物。乙炔气体和氧气反应能产生高温火焰(氧炔焰),工人师傅常用氧炔焰切割或焊接金属构件。现在让我们一起对乙炔燃烧(氧炔焰)的产物进行探究。
【查阅资料】当还原性气体中混有水蒸汽时,则难以还原氧化铜。
【提出问题】乙炔燃烧的产物中除水外主要还有哪些物质?
【假设与猜想】猜想:①一定有______;②可能有一氧化碳。
【实验设计】根据上述两种物质的猜想设计如下实验:
(1)在氧炔焰上方罩一个内壁附着有_____的大烧杯,观察现象。
(2)将乙炔燃烧的产物依次通入足量的澄清石灰水和足量的浓硫酸,将剩余气体通过炽热的氧化铜,若氧化铜变红,说明有(填写化学式)____。
【证据与结 论】
论】
实验(1):观察到烧杯内壁附着的____,则猜想①成立。反应的化学方程式为:_____。
 实验(2):若氧化铜变红,则猜想②成立。
实验(2):若氧化铜变红,则猜想②成立。
【分析与交流】实验(2)时,若将乙炔燃烧的产物依 次通入足量的浓硫酸和足量的澄清石灰水,再将剩余气体通过炽热的氧化铜,此时氧化铜不变红,能否证明猜想②不成立?____(填“能”或“不能”)。
次通入足量的浓硫酸和足量的澄清石灰水,再将剩余气体通过炽热的氧化铜,此时氧化铜不变红,能否证明猜想②不成立?____(填“能”或“不能”)。
四、计算题(本大题包括1小题,共5分)
16.(5分)向154.7 g一定质量分数的稀硫酸溶液中放入10.0 g粗锌(含有不溶于稀硫酸的杂质),恰好完全反应,共收集到标准状况下的氢气2.24 L。(锌的相对原子质量为65;标准状况下氢气的密度约为0.09 g/L)
计算 :(均保留1位小数)
:(均保留1位小数)
(1)反应产生氢气的质量。
(2)反应结束后,过滤,滤渣的 质量。
质量。
(3)反应后所得溶液的溶质质量分数。