(单词翻译:单击)
试卷真题
一、选择题(本题共20小题,每小题2分,共40分。每小题只有一个选项符合题意)
1.下列物质不属于有机高分子材料的是
A.普通玻璃 B.合成纤维 C.天然橡胶 D.塑料薄膜
2.下列过程发生了化学变化的是
A.水的沸腾 B.胆矾研碎 C.过滤液体 D.酸碱中和
3.今年中国环境日(6月5日)的主题是“向污染宣战”。下列措施会引起环境污染的是
A.合理推广使用新能源 B.大量燃烧含硫燃料
C.控制家用汽车的使用 D.分类回收处理垃圾
4.下列有关的图示和图标中正确的是
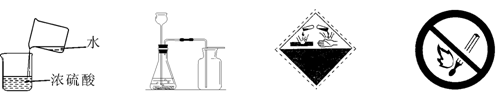
A.浓硫酸的稀释 B.实验室制取CO2 C.当心火灾 D.禁止吸烟
5.下列说法正确的是
A.化石燃料主要包括煤、石油、天然气,属于可再生能源
B.可燃冰就是干冰,主要成分为CO2
C.乙醇是一种很好的燃料,属于不可再生能源
D.点燃氢气前一定要检验其纯度
6.溶液是自然界中常见的物质。下列有关溶液的说法正确的是
A.溶液的上层浓度小,下层浓度大
B.溶液蒸干后,均能得到固体溶质
C.溶液中只有一种溶质时,溶液为纯净物
D.物质在溶解得到溶液的过程中,通常有放热或吸热的现象出现
7.下列说法正确的是
A.糖类、油脂、蛋白质都是由C、H、O三种元素组成的高分子化合物
B.我们不需要从食物中摄取维生素,因为多数维生素能在人体内合成
C.由于缺碘会引起甲状腺肿大,所以我们要多食用加碘食盐
D.由于霉变食物中含有能损害人的肝脏、诱发肝癌等疾病的黄曲霉毒素,因此,我们绝对不能食用霉变食物
8.在光照或点燃条件下,氢气和氯气发生反应生成氯化氢,其反应的微观示意图如右。下列说法正确的是 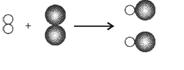
A.所有化学反应在反应前后分子个数都不发生变化
B.此反应过程中只有物质变化,没有能量变化
C.在任何条件下,H2和Cl2均不能大量共存
D.由微观示意图可知:2gH2和71gCl2发生反应可生成73gHCl
9.人类每时每刻都离不开空气,通过治理,株洲市的空气质量近年来有所好转。下列有关空气的说法不正确的是
A.空气是由多种单质和化合物组成的混合物
B.空气中含量较多且化学性质活泼的是氮气
C.呼吸、燃烧、炼钢、化工生产等都要用到氧气
D.空气是一种宝贵的自然资源,要保护空气,防止污染空气
10.下列处理方法不正确的是
A.炒菜时油锅中的油不慎着火,可用锅盖盖灭
B.扑灭森林火灾的有效方法之一是将大火蔓延路线前的一片树木砍掉,形成隔离带
C.不慎碰倒酒精灯,酒精在桌面上燃烧起来,应立即用水浇灭
D.遇到火灾时,可用湿毛巾捂住口鼻,蹲下靠近地面或沿墙壁跑离着火区域
11.河水因含有杂质而需要净化。下列操作都是净化水的方法,其中一定需要加热的是
A.过滤 B.吸附 C.蒸馏 D.沉淀
12.某物质W在空气中完全燃烧后的产物只有二氧化碳和水。根据以上信息,下列关于物质W组成的说法中正确的是
A.含有C、H、O三种元素 B.只含C、H元素
C.含有C、H元素,可能含有O元素 D.含有C元素,可能含有H、O元素
13.中国南车株洲时代集团生产的油电双动力公交车因省油、环保而在全国推广,双动力公交车制造需要大量使用金属材料。下列有关金属材料的说法正确的是
A.金属材料中一定不含有非金属元素
B.多数合金的抗腐蚀性能比组成它们的纯金属更好
C.双动力公交车所有部件都是由金属材料制造的
D.地球上的金属资源是取之不尽、用之不竭的
14.地球上可利用的淡水不到总水量的1%,我们应爱护水资源。下列有关水的说法正确的是
A.海水都是混合物,淡水都是纯净物
B.通过水的电解实验可以得到“水是由氢气和氧气组成”的结论
C.爱护水资源主要应从节约用水和防治水体污染两方面采取措施
D.硬水是含有可溶性钙、镁化合物的水,软水是不含可溶性钙、镁化合物的水
15.下图是X、Y、Z、W四种金属与稀盐酸反应状况的示意图,据此判断四种金属中活动性最弱的是
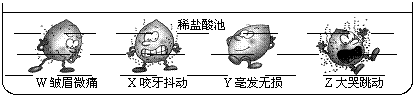
A.X B.Y C.Z D.W
16.我市湘江风光带桥头广场上介绍侯德榜曾在株洲开办“永利化工厂”,利用联合制碱法(侯氏制碱法)生产纯碱。下列有关联合制碱法的原料(氯化钠、二氧化碳、氨气、水)与产品(碳酸钠、氯化铵)的说法不正确的是
A.碳酸钠广泛应用于玻璃、造纸、纺织和洗涤剂的生产
B.氯化钠在自然界中分布很广,海洋、盐湖、盐井、盐矿等都是氯化钠的来源
C.侯氏制碱法消耗了二氧化碳,极大地缓解了酸雨的形成
D.氯化铵与熟石灰粉末混合研磨,放出具有刺激性气味的氨气
17.下列反应中属于置换反应的是
A.C+CO2 2CO B.3CO+Fe2O3
2CO B.3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
C.2Na+2H2O=2NaOH+H2↑ D.Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
18.我们学化学、用化学、爱化学。下列有关化学的说法中合理的是:①化学在保证人类生存与不断提高生活质量方面起着重要的作用 ②绿色化学使更多的化学工艺和产品向着环境友好的方向发展 ③门捷列夫发现了元素周期律之后,化学学习与研究变得有规律可循 ④化学不但研究原子、分子的性质,而且要深入研究电子、质子、中子的性质
A.①②③ B.②③④ C.①②④ D.①③④
19.归纳推理是学习化学的重要方法之一。下列有关事实和推理得到的结论合理的是
事实 | 结论 | |
A | 二氧化锰对氯酸钾分解和过氧化氢分解均有催化作用 | 不同的反应有时可以使用同一种物质作催化剂 |
B | 白磷和红磷均是由磷元素组成的单质 | 白磷和红磷属于同一种物质 |
C | C与O2反应能放出大量的热 | C与O2不需要任何条件就可以发生反应 |
D | Al在常温下就能与O2发生发应,Fe在常温下几乎不与O2反应 | Al的抗腐蚀性能比Fe弱 |
20.已知:某密闭容器中,12g A加热完全分解产生B和C,其中B的质量为2g,同时C又能部分分解产生0.1g D和7.9g E,则最终该密闭容器中B和C的质量比为
A.1∶1 B.1∶2 C.1∶4 D.1∶5
二、填空题(本题共6小题,共22分)
21.(4分)请用化学用语填空:
(1)2个镁离子____________; (2)生理盐水中的溶剂分子____________;
(3)硝酸铵的化学式____________; (4)钻石的主要成分____________。
22.(4分)现有CO2、H2O、CH4、NO2(二氧化氮)、O3、SO2、NO(一氧化氮)等七种物质。
(1)其中不属于氧化物的是____________。
(2)二氧化硫与二氧化碳一样,都能与水发生化合反应。请写出二氧化硫与水反应的生成物的化学式____________。
(3)一氧化氮与氧气化合可生成二氧化氮,请写出反应的化学方程式____________。
23.(3分)下图中A、B、C、D是四种粒子的结构示意图,请回答下列问题:
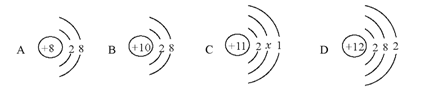
(1)以上四种结构示意图所表示的粒子中,属于非金属元素的是____________(填字母代号)。
(2)以上四种结构示意图所表示的粒子中,易失去电子的是 ____________(填字母代号)。
(3)C中x = ____________ 。
24.(3分)混盐一般是由一种阳离子与两种酸根离子组成的盐,如:Ca(NO3)Cl。漂白粉中有一种混盐CaOCl2(其中钙元素的化合价为+2,氧元素的化合价为-2)。
(1)已知CaOCl2中的一种酸根离子是次氯酸根离子(ClO—),则另一种酸根离子对应的酸的化学式为 。若将该混盐改写成如Ca(NO3)Cl的形式,其化学式可表示为____________ 。
(2)在Ca(NO3)Cl中氮元素的化合价为 ____________。
25.(3分)如图所示为①硝酸钾、 ②氯化钠 、③硼酸(H3BO3)的溶解度曲线图。由图可知:
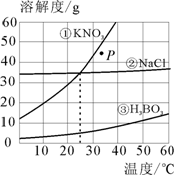
(1)当温度为25℃时,硝酸钾、氯化钠和硼酸三种物质的溶解度大小关系为_________(请用序号作答)。
(2)图中P点表示硝酸钾的 _________(填“饱和”或“不饱和”)溶液。
(3)从图中可得到的有关硼酸溶解度的信息有:硼酸的溶解度随着温度的升高逐渐增大、_________(任写一条)等。
26.(5分)晶体硅在电子工业中有广泛的应用。工业上生产高纯硅的流程如下:

请回答下列问题:
(1)二氧化硅与焦炭反应的另一种产物是一氧化碳。该反应的化学方程式为 _________。
(2)蒸馏属于_________变化(填“物理”或“化学”)。
(3)完成由下列纯SiHCl3制取高纯硅的化学方程式:

三、简答题(本题共2小题,共10分)
27.(4分)请用所学的知识回答下列问题:
(1)为什么油库、面粉厂都要严禁烟火?
(2)某温度下,华雪同学用纯净的氯化钠固体配制好5%的氯化钠溶液后,用pH计(精确测定溶液pH的仪器)测得该氯化钠溶液的pH=6.5,于是得出氯化钠溶液呈酸性的结论。你认为华雪同学的结论是否正确?若不正确,还需要增加什么对比实验?
28.(6分)绝大多数金属都能与Cl2直接化合生成金属氯化物,如2Na+ Cl2=2NaCl、Cu+ Cl2  CuCl2等。已知A、B、C、D、E五种物质有如下图转化关系(个别反应条件已略去)。
CuCl2等。已知A、B、C、D、E五种物质有如下图转化关系(个别反应条件已略去)。

已知A是地壳中含量仅次于铝的金属元素的单质,C为紫红色金属单质,A 、C都能与Cl2直接化合生成相应的金属氯化物B、E。回答下列问题:
(1)A为_________、B为 _________。
(2)D与Cl2化合生成E的化学方程式为_________。
(3)A与E也可以化合生成D,请写出化学反应方程式_________。
四、实验与探究题(本题共2小题,共18分)
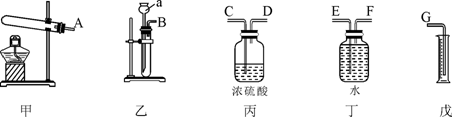 29.(6分)现有某黄铜(铜锌合金,假定其他成分均不与盐酸反应)样品,请从下图中选择适当的实验装置,设计最简单的实验测定该黄铜样品中锌的质量分数并回答下列问题:
29.(6分)现有某黄铜(铜锌合金,假定其他成分均不与盐酸反应)样品,请从下图中选择适当的实验装置,设计最简单的实验测定该黄铜样品中锌的质量分数并回答下列问题:
(1)写出仪器a的名称:_________。
(2)实验要选择的装置是_________(填装置编号)。若产生的气体从左向右流,则接口的顺序为 _________(填接口字母代号);
(3)细心观察发现:盛装溶液的试剂瓶与收集气体的集气瓶都有磨砂部分,所不同的是集气瓶的磨砂部分位于 _________。
a.瓶底内壁 b.瓶口边缘 c.瓶颈内壁 d.瓶底外壁
(4)仪器组装好后,在开始实验时,要先_________。
(5)若实验样品的质量是9.9g,实验中测定氢气的体积是1.1L(氢气密度为0.09g/L),则该黄铜样品中锌的质量分数为 _________。
30.(12分)甲、乙两同学在学完酸的化学性质后,做了如下实验:
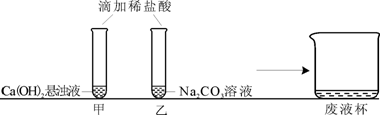
【观察与讨论1】甲同学在做实验时观察到的明显现象是 ① 。再滴加无色酚酞溶液,无明显现象(已知CaCl2溶液呈中性)。
【观察与讨论2】乙同学在做实验时开始没有观察到气泡产生,于是对碳酸钠能否与盐酸反应表示怀疑。甲同学通过查阅资料得知:在碳酸钠溶液中滴加少量稀盐酸,先发生反应Na2CO3+HCl=NaCl+NaHCO3,继续滴加稀盐酸,再发生反应NaHCO3+HCl=NaCl+H2O+CO2↑。所以甲同学认为,乙同学实验时还应 ② ,才能观察到有气泡产生。
【观察与讨论3】甲同学先将废液缓慢倒入一洁净的废液杯中,乙同学在观察到气泡产生后,也将实验废液缓慢倒入该废液杯中,没有观察到明显现象。经过讨论确定,甲同学的试管中废液含有的溶质一定有 ③ ,乙同学的试管中废液含有的溶质一定有 ④ (均写化学式)。
为了处理实验后产生的废液,甲、乙同学决定对废液杯中最终废液溶质的成分进行探究。
【提出问题】最终废液中含有什么溶质?
【猜想与假设】猜想1:废液中含有 ⑤ (写化学式)两种溶质。
猜想2:废液中含有 ⑥ (写化学式)三种溶质。
猜想3:废液中含有NaHCO3、CaCl2、 NaCl三种溶质。
【活动与探究】甲、乙同学为了验证猜想,进行了如下实验:
甲同学实验:取少量废液于试管中,向其中滴加盐酸,无气泡产生。
乙同学实验:取少量废液于试管中,向其中滴加紫色石蕊试液,溶液变红色。
【结论与反思】(1)猜想 ⑦ (填“1”或“2” 或“3”)正确。
(2)要得到相同的结论,还可采用很多种方法。如加入氧化铁粉末,可观察到溶液呈 ⑧ 色,该反应的化学方程式为 ⑨ 。
【表达与交流】甲、乙同学确认了最终废液中溶质的成分,若直接排放,可能造成的危害是
⑩ ,你认为处理该废液的方法是 ⑪ 。
五、计算题(本题共2小题,共10分)
31.(4分)人体胃酸过多会引起胃病。右图为某抗酸药包装标签上的部分文字,请回答下列问题。

(1)Al(OH)3的相对分子质量为________________。
(2)经测定,每片该抗酸药实含氢氧化铝234mg。计算一片该抗酸药可消耗7.3%的盐酸多少克(请写出计算过程)?
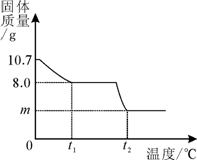
32.(6分)胆矾晶体部分失水后得到某硫酸铜晶体(CuSO4·xH2O),华雪同学为研究CuSO4·xH2O加热后所得物质的组成,做了以下实验:取10.7gCuSO4·xH2O晶体加热使其分解,绘制出固体的质量随温度的变化关系图。如图所示,到t1℃时该固体完全失去结晶水,化学方程式为:CuSO4·xH2O  CuSO4+ xH2O↑
CuSO4+ xH2O↑
(1)计算该硫酸铜晶体(CuSO4·xH2O)中x的值。(CuSO4·x H2O的相对分子质量为:160+18x)
(2)CuSO4中铜元素的质量分数是多少?
(3)升温到t2℃,残留固体是黑色物质,则m=___________g。(写出求m的过程)
试题答案
株洲市2014年初中毕业学业考试化学试卷
参考答案及评分标准
一、选择题(每小题2分,共40分)
题次 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | A | D | B | B | D | D | D | D | B | C |
题次 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
答案 | C | C | B | C | B | C | C | A | A | A |
二、填空题(本题共6小题,除指明分数外,每空1分,共22分)
21.(4分) (1)2Mg2+ (2)H2O (3)NH4NO3 (4)C
22.(4分) (1)CH4、O3 (2)H2SO3 (3)2NO+O2=2NO2 (2分)
23.(3分) (1)AB (2)CD (3)8
24.(3分) (1)HCl Ca(ClO)Cl (2)+5
25.(3分) (1)①=②>③ (2)不饱和 (3)答案合理即可
26.(5分) (1)2C+SiO2 Si+2CO↑(2分) (2)物理 (3)3 HCl
Si+2CO↑(2分) (2)物理 (3)3 HCl
三、简答题(除指明分数外,每空1分,共10分)
27.(4分)
(1)可能发生爆炸(油库、面粉厂周围的空气中混有可燃性的气体或粉尘,遇明火会发生急剧燃烧,短时间内聚积大量热,在有限的空间内气体体积迅速膨胀而引起爆炸)。(2分)
(2)不正确 测定蒸馏水的pH
28.(6分)
(1)Fe CuCl2 (2)2FeCl2+Cl2=2FeCl3 (2分) (3)2FeCl3+Fe=3FeCl2 (2分)
四、实验与探究题(除指明分数外,每空1分,共18分)
29.(6分)
(1)长颈漏斗 (2)乙丁戊 B、F、E、G (3)b (4)检查装置的气密性(5)32.5%
30.(12分)
①悬浊液变澄清 ②继续滴加稀盐酸 ③CaCl2 ④NaCl
⑤NaCl、CaCl2 ⑥NaCl、CaCl2、HCl ⑦ 2 ⑧黄
⑨Fe2O3+6HCl=2FeCl3+3H2O (2分) ⑩腐蚀下水道等答案合理即可
⑪将废液用熟石灰中和至中性再排放
五、计算题(本题共2小题,共10分)
31.(4分)
(1)78 (2分)
(2)设1片该抗酸药可消耗7.3%的盐酸的质量为x,则:
3HCl + Al(OH)3=AlCl3+3H2O
109.5 78
x×7.3% 234×10-3 g
109.5∶78= x×7.3%∶234×10-3 g 解得x =4.5g (2分)
32.(6分)
(1) CuSO4·xH2O  CuSO4+ xH2O↑
CuSO4+ xH2O↑
160 18x
8.0g (10.7-8.0)g
160∶8.0 g =18x∶(10.7-8.0)g 解得:x=3 (2分)
(2)CuSO4中铜元素的质量分数=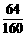 ×100%=40% (2分)
×100%=40% (2分)
(3)由题意知,升温到t2℃时,残留的黑色物质为CuO,依据质量守恒定律,CuSO4与CuO之间存在如下关系:CuSO4∽CuO
160 80
8.0g m g
160∶8.0 g=80∶m g 解得:m=4.0 (2分)


