(单词翻译:单击)
一、单项选择题(本大题包括1 5小题。其中第1-10小题每小题1分,第11-15小题每小题2分,共20分。每小题有四个选项,其中只有一个选项符合题意,请将正确选项的代号填涂在答题卷的相应位置上)
1.下列生活用品用金属材料制作而成的 是
是
2.下列变化属于化学变化的是
A.粉笔折断B.香蕉腐烂C.雪糕融化D.汽油挥发
3.下列物质不属于空气污染物的是
A.氧气B.一氧化碳C.烟尘D.氮的氧化物
4.下列取用固体药品的操作正确的是

5.南昌今年启动“中国水都’’工程建设。下列关于水的说法不正确的是
A.水是人类宝贵的资源B.长期饮用蒸馏水有益健康
C.水是一种常用的溶剂D.自然界的水都是混合物
6.用灯帽盖灭酒精灯的灭火原理是
A.清除可燃物B.降低酒精的着火点
C.隔绝空气D.降低温度至酒精的着火点以下
7.江西武宁白钨矿储量丰富,有望成为世界钨都。白钨矿主要成分是钨酸钙(CaWOx),其中钨元素的化合价为+6价,则X是
A.2B.3C.4D.5
8.右图是a,、b、c三种固体物质的溶解度曲线。下列叙述不正确的是
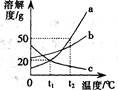
 A.物质C的溶解度随温度的升高而减小
A.物质C的溶解度随温度的升高而减小
B.t2℃时,物质a的饱和溶液溶质的质量分数为50%
C.温度高于t1℃时物质a的溶解度大于物质c的溶解度
D.将t2℃时物质b的饱和溶液降温至t1℃时溶质的质量分数会减小
9.蚊虫叮咬时分泌的蚁酸(CH2O2)会使人体皮肤肿痛。下列有关蚁酸的说法正确的是
A.蚁酸是氧化物 B.蚁酸是由碳、氢、氧三种原子构成
C.蚁酸中碳、氧元素的质量比为l:2 D.蚁酸中氢元素质量分数最小
10.“催化转换器”能将汽车尾气中的有害气体转化为无害气体,其反应微观示意图如下。下列叙述不正确的是
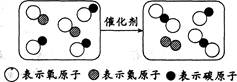
A.反应前后原子个数不变
B.反应前后分子种类不变
C.反应前后原子种类不变
D.参加反应的两种分子个数比为l:1
11.物质的组成和结构决定物质的性质。下列解释合理的是
A.生铁与钢的性能不同的原因是含碳量不同
B.稀盐酸与稀硫酸的化学性质相似的原因是都含有酸根离子
C.H2O与H2O2的化学性质不同的原因是原子个数不同
D.金刚石与石墨的物理性质差异大的原因是碳原子的结构不同
12.下列实验方案合理的是
选项 | 实验目的 | 所用试剂或方法 |
A | 除去氧化钙中的碳酸钙 | 加水溶解、过滤、蒸发 |
B | 测定溶液的酸碱度 | 紫色石蕊试液 |
C | 软化硬水 | 加入肥皂水,搅拌 |
D | 验证镁、铜、银的金属活动性 | 镁、银、硫酸铜溶液 |
13.小明发现月饼盒里的脱氧剂部分呈红褐色,查阅资料得知脱氧剂中含有铁粉和活性炭。
他猜想这包脱氧剂中可能含有:①Cu和C;②Fe2O3和C;③Fe3O4和C;④Fe3O4、C和Fe; ⑤Fe2O3、C和Fe。其中猜想合理的是
A.①③⑤B.②④⑤ C.②⑤D.④⑤
14.下表物质 符合图中转化关系
符合图中转化关系 的是
的是
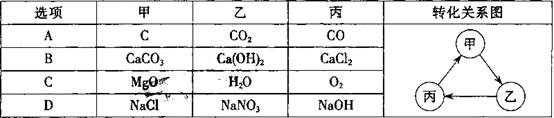
15.下列图像正确的是
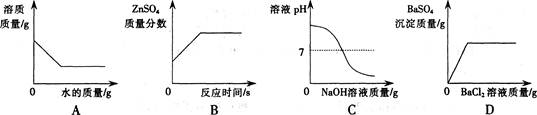
A.向一定量的硝酸钾溶液中不断加水
B.向一定量的稀硫酸中不断加锌粉
C.向一定量的稀盐酸中不断加氢氧化钠溶液
D.向一定量的 硫酸和硫酸铜混合溶液中不断加氯化钡溶液
硫酸和硫酸铜混合溶液中不断加氯化钡溶液
二、填空题(本大题包括3小题,化学方程式2分,其它每空l分,共1 4分)
温馨提示:本大题的选择填空有1~2选项符合题意,漏选给0. 5 分,错选、多选不给分。
分,错选、多选不给分。
1 6.(5分)请从指定的H、N、O、S、Al五种元素中选择合适的元素,按下列要求用化学用语表示:
(1)金属元素______________;
(2)空气中含量最多的气体_______________ __;
__;
(3)人体含量最多的物质中氧元素的化合价______________;
(4)中和反应____________(写一个)。
17.(4分)紫薯营养丰 富,具有特殊的保健功能。紫薯中富含淀粉、蛋白质、维生素A、维生素B、维生素C、锌、铁、钙、硒等。
富,具有特殊的保健功能。紫薯中富含淀粉、蛋白质、维生素A、维生素B、维生素C、锌、铁、钙、硒等。

(1)紫薯中维生素_____________(选填“A”、“B”或“C")可预防坏血病;
(2)紫薯中还缺乏一种能给人体供能的营养素是______________________;
(3)紫薯中的硒元素被誉为“抗癌大王”。硒元素的部分信息如右下图,则下列说法中正确的
是____________;
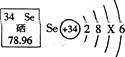
A.硒元素的相对原子质量为78.96g B.一个硒原子中有34个中子
C.硒原子结构示意图中的X=18D.硒元素在化合物中可能显一2价
(4)紫薯种植常需施用复合肥。现有硝酸铵、硝酸钾、氯化钾、氯化铵、碳酸钾几种化肥,其中属于复合肥的是________________。
18.(5分)工业上常用“碳捕捉"技术将CO和CO2混合气体中的CO2捕捉并回收CO,其基本过程如下图所示(部分条件及物质未标出)。
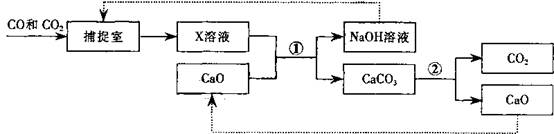
(1)反应②分离出的CO2可制成干冰,干冰常用于____________;
(2)反应①在“反应分离室"内进行。将NaOH溶液与CaCO3分离的操作是______________;
(3)“捕捉室”中发生反应的化学方程式为____________;
(4)下列有关该捕捉过程的叙述正确的有________。
A.捕捉到的CO2可制备其它化工产品,减少了温室气体排放
B.“反应分离室"中的反应要吸收大量热
C.整个过程中,只有一种物质可循环利用
D.能耗大是该捕捉技术的一大缺点
三、推断题(本大题包括1小题,化学方程式2分,其它每空l分,共6分)
19.(6分)如右图所示A~F是初中化学常见的物质。图中“→”表示转化关系,“一"表示相互能反应(部分物质和反应条件未标出)。其中A是紫红色金属,B常温下是气体,C是人体胃液中含有的酸。
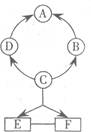
(1)A的一种用途是___________;
(2)B的化学式为___________;
(3)D物质属于__________(选填“氧化物"、“酸”、“碱"或“盐”);
(4)E和F反应的化学方程式为__________;
(5)右图转化关系中没有涉及到的基本反应类型是____________。
四、实验题(本大题包括1小题。化学方程式2分,其它每空l分,共8分)
20.(8分)下图是实验室常用的一些装置。
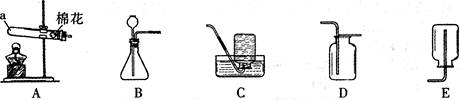
(1)仪器a的名称是___________;
(2)实验室制取并收集二氧化碳气体应选择的装置是__________(填字母),检验二氧化碳是否
收集满的方法是_________;
(3)用装置A与C连接制取并收集氧气,则装置A中反应的化学方程式为____ ______________,当观察到装置C中__________________时才开始收集;
______________,当观察到装置C中__________________时才开始收集;
(4)SO2通常是一种无色有刺激性气味的有毒气体,密度比空气大,易溶于水,排放到空气中会形成酸雨。实验室用右图装置收集一瓶干燥的SO2,装置的导管按气流方向连接的顺序是 __→ → → →e(填字母),装置中的X是_________。
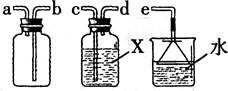
五、活动与探究题(本大题包括1小题,每空1分,共6分)
21.(6分)小雨阅读课外资料得知:双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是她对氧化铜产生了探究兴趣。
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)。

(1)上述实验应测量的“待测数据"是_________;
(2)若实验②比实验①的“待测数据”更___________(选填“大"或“小"),说明氧化铜能加快氯酸钾的分解速率;
(3)将实验②反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到0.5g黑色粉末,说明
________________;
(4)再将该黑色粉末放入试管中,加入________________,若观察到_______,说明黑色粉末的化学性质在反应前后保持不变。
【预期结论】氧化铜还能作氯酸钾分解的催化剂。
【评价设计】你认为小雨设计实验③和实验②对比的目的是_________________。
六、计算题(本大题包括1小题,共6分)
22.(6分)为测定某赤铁矿石中氧化铁的质量分数,小龙和他的同学用足量的一氧化碳与l0g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如右图。
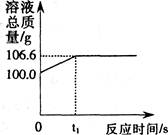
(1)上述反应产生二氧化碳的质量为__________g;
(2)计算该赤铁矿石中氧化铁的质量分数;
(3)若上述反应后剩余固体质量为m克,写出计算该赤铁矿石中氧化铁质量分数的表达式:_____________(用m表示)。
化学试题参考答案及评分意见
一、单项选择题
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
答案 | B | B | A | D | B | C | C | B | D | B | A | D | C | C | D |
二、填空题
说明:本大题选择填空有l~2个选项符合题意,漏选给0.5分,错选、多选不给分。
16.(5分)(1)Al(1分)(2)N2(1分)(3)H2O(1分)
(4)2Al(OH)3+3H2SO4 =Al2(SO4)3+6H2O(其他答案合理均可)(2分)
=Al2(SO4)3+6H2O(其他答案合理均可)(2分)
17.(4分)(1)C(1分)(2)油脂(1分)(3)C、D(1分)(4)硝酸钾(1分)
1 8.(5分)(1)人工降雨(其他答案合理均可)(1分)(2)过滤(1分)
(3)CO2+2NaOH=Na2CO3+H2O(2分)(4)A、D(1分)
三、推断题(本大题包括1小题,化学方程式2分,其它每空l分.共6分)
19.(6分)(1)作导线(其他答案合理均可)(1分)(2)H2(1分)(3)盐(1分)
(4)CO2+H2O=H2CO3(2分)(5)分解反应(1分)
四、实验题(本大题包括1小题。化学方程式2分。其它每空l分,共8分)
20.(8分)(1)试管(1分)
(2)B、D(1分)将燃着的木条放在集气瓶口,若木条熄灭,则CO2已集满(1分)
(3) 2KMnO4  K2MnO4+MnO2+O2↑(2分)气泡连续均匀放
K2MnO4+MnO2+O2↑(2分)气泡连续均匀放 出(1分)
出(1分)
 (4)c→d→b→a(1分) 浓硫酸(1分)
(4)c→d→b→a(1分) 浓硫酸(1分)
五、活动与探究题(本大题包括1小题,每空1分,共6分)
2 1.(6分)【设计实验】(1)所需时间(1分)(2)小(1分)
 (3)黑色粉末的质量在反应前后保持不变(1分)
(3)黑色粉末的质量在反应前后保持不变(1分)
(4)适量双氧水(过氧化氢溶液)或稀硫酸(1分)
大量气泡或溶液变蓝色(其他合理答案均可)(1分)
【评价设计】探究氧化铜是否比二-氧化锰的催化效果更好(1分)
六、计算题(本大题包括1小题。共6分)
22.(6分)(1)6.6 (1分)
(2)解:设该样品中氧化铁质量为x………………… (设、答不给分,没写扣0.5分)
3CO+Fe2O3高温2Fe+3CO2……………………………………………………(1分)
1603×44
x 6.6g
6.6g
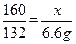 …………………………………………………… (1分)
…………………………………………………… (1分)
x=0.8g ………………………………………………………………… (1分)
样品中氧化铁的质量分数为: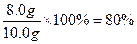 ……………………………… (1分)
……………………………… (1分)
答:该样品中氧化铁质量分数为80%。
(3) 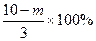 (1分)
(1分)


