(单词翻译:单击)
1.液氧转化为氧气的过程中,发生的变化是
A.混合物变为纯净物 B.分子间的空隙增大 C.化学性质发生变化 D.分子总数增加
【知识点】
混合物与纯净物的区别;物理变化与化学变化的本质区别;
【答案】B
【考查能力】
本题主要考查学生概念的辨析能力;根据物质的变化分析微粒的变化
【解析】
A、液氧与氧气都是由氧分子构成的,液氧与氧气属于同种物质都是纯净物,所以A不符合题意。
B、液氧转化为氧气,分子本身没变,分子之间的间距变大,所以B符合题意。
C、液氧转化为氧气,分子本身没变,没有新物质生成,所以显然化学性质不变,所以C不符合题意。
D、液氧转化为氧气,分子本身没变,分子的总数不会增加,只是分子之间的间距变大。所以D不符合题意。
【易错点】不理解液氧和氧气都是由氧分子构成,物质的构成相同,所以容易错选为A.
2.以下几种实验操作,不正确的是
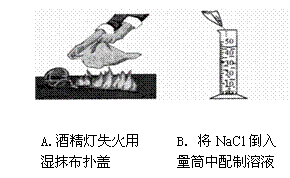

 【知识点】灭火的原理,溶液的配制,量筒的正确使用方法,闻气体的方法,物质的分离方法,过滤的正确操作方法。
【知识点】灭火的原理,溶液的配制,量筒的正确使用方法,闻气体的方法,物质的分离方法,过滤的正确操作方法。
【答案】B
【考查能力】
本题主要考查学生对基本实验操作正确与否的判断,要求同学们要熟练掌握基本概念和基本方法及实验的操作注意事项.
【解析】
A、酒精灯失火用湿抹布铺盖,采用隔绝空气的方法灭火,所以A不符合题意;
B、量筒不能作为反应容器和配制容器,所以B符合题意;
C、闻气体时用手轻轻扇动,让少量气体飘进鼻孔,即扇闻,所以C不符合题意;
D、分离固液的混合物时可用过滤的分离方法,而且题中过滤操作正确。所以D不符合题意。
3.某些电子集成电路常用黄金镀膜。废旧电子产品上的黄金通过某种溶液的溶解后,加入某种金属,即可回收。对黄金在电子产品上的应用和回收过程,下列说法错误的是
A.集成电路用黄金镀膜可防止线路氧化 B.回收时往溶液中加入的金属可以选用铜
C.回收时溶解黄金的溶液不会是硫酸D.回收时加入的金属与溶液发生了化合反应
【知识点】
置换反应的条件;影响金属与氧气反应的速率的因素;
【答案】D
【考查能力】
主要考查对金属与酸和盐溶液发生置换反应的条件的而理解;影响金属与氧气反应的速率的因影响金属与氧气反应的速率的因素;
【解析】
A、金在金属活动性顺序表中排在最后面,活动性很差,在空气中不能被氧化,所以A不符合题意;
B、在金属活动性顺序表中铜排在金前面,所以,铜可以把金从它的盐溶液中置换出来;
C、金在金属活动性顺序表中排在氢后面,金不会溶于稀硫酸,所以C不符合题意。
D、制取金属金的单质,说明回收时加入的金属与溶液发生了置换反应,所以D符合题意。
【易错点】学生对金属与酸和盐溶液发生置换反应的条件的理解不深,所以错答成C.
4.某同学为研究相同条件下一氧化碳和氢气哪个还原氧化铁的量更多,将一氧化碳和氢气等体积混合后先通过图甲装置,再通过图乙中的仪器组合。为达到实验目的,图乙中仪器选择和连接最好的是
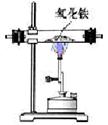
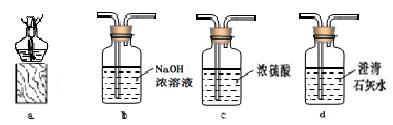
图甲 图乙
A.cba B.cda C.cbd D.bca
【知识点】气体成分的分析、化学实验的基本原理
【答案】A
【考查能力】
主要考查实验装置的选择组装能力,气体的除杂检验能力,尾气处理分析能力
【解析】
一氧化碳和氢气等体积混合后还原氧化铁,要想知道哪个还原氧化铁的量更多,我们要根据生成的二氧化碳和水的质量进一步求出。要知道生成二氧化碳和水的质量,我们要先用浓硫酸质量变化测出生成水的质量,再用氢氧化钠溶液的质量变化测出生成二氧化碳的质量,然后进行尾气处理,防止未反应的一氧化碳污染空气。因为氢氧化钙的溶解度小,所以我们选择氢氧化钠,若先除二氧化碳会使所测水的质量变大,影响实验结果。所以正确的顺序是A、cba
【易错点】
学生不理解定量实验中水蒸气要先吸收,再吸收二氧化碳,如果先吸收二氧化碳会重新带上水,使水的测量值变大,会错答成D
5.在氢氧化钠溶液中加入一定量的稀盐酸后,下列实验能证明两者恰好完全中和的是
A.滴入适量FeCl3溶液,溶液变黄,但无沉淀生成
B.滴入几滴酚酞试液,酚酞试液不变色
C.测得反应后溶液中Na+与Cl-的个数比为1:1
D.滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀
【知识点】
酸碱中和反应;指示剂变色反应;酸碱盐之间的反应及化学常见实验现象的分析
【答案】C
【考查能力】主要考查酸碱盐之间的反应及化学常见实验现象的分析能力;
酸碱中和反应恰好反应及过量问题的分析
【解析】
A、滴入适量FeCl3溶液,溶液变黄,但无沉淀生成。如果盐酸过量也不会有沉淀的生成。所以A不符合题意;
B、滴入几滴酚酞试液,酚酞试液不变色。酚酞试液在酸性和中性条件下均不显色 ,所以B不符合题意;
,所以B不符合题意;
C、测得反应后溶液中Na+与Cl-的个数比为1:1。当氢氧化钠溶液和稀盐酸恰好完全反应,溶液中Na+与Cl-的个数比为1:1,所以C符合题意;
D、滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀。只要滴入稀盐酸,Cl-都会和Ag+生成沉淀,不管是过量还是恰好完全反应,所以D不符合题意。
【易错点】在氢 氧化钠溶液中加入一定量的稀盐酸后,滴入适量FeCl3溶液,溶液变黄,但无沉淀生成,只能判断氢氧化钠和盐酸发生了反应,却不能证明恰好反应,如果不仔细读题,就容易错答成A.
氧化钠溶液中加入一定量的稀盐酸后,滴入适量FeCl3溶液,溶液变黄,但无沉淀生成,只能判断氢氧化钠和盐酸发生了反应,却不能证明恰好反应,如果不仔细读题,就容易错答成A.
6.一定质量的氢氧化钡溶液中逐渐加入碳酸钠粉末(不考虑溶液体积变化),直至过量。如图横坐表示加入碳酸钠粉末的质量,根据图像判断,纵坐标可能表示

A.生成沉淀的质量 B.溶液中溶剂的 质量
质量
C.溶液中溶质的质量 D.溶液的pH
【知识点 】酸碱盐之间的反应
【答案】C
【考查能力】根据酸碱盐之间的反应判断判断溶液中溶质、溶剂、pH值等变化
【解析】
A 一定质量的氢氧化钡溶液中逐渐加入碳酸钠粉末直至过量,产生碳酸钡的质量应该先逐渐增加,而后不变,所以A不符合题意;
B、溶液中溶剂没有参加反应,也没有产生,应该不变,所以B不符合题意;
C、一定质量的氢氧化钡溶液中逐渐加入碳酸钠粉末直至 过量,根据化学反应物质之间的质量比可以知道生成的碳酸钡沉淀的质量大于加入的碳酸钠粉末的质量,所以溶液中的溶质的质量先减小;当一定质量的氢氧化钡溶液反应完,碳酸钠粉末过量所以溶质质量变大。
过量,根据化学反应物质之间的质量比可以知道生成的碳酸钡沉淀的质量大于加入的碳酸钠粉末的质量,所以溶液中的溶质的质量先减小;当一定质量的氢氧化钡溶液反应完,碳酸钠粉末过量所以溶质质量变大。
D、一定质量的氢氧化钡溶液中逐渐加入碳酸钠粉末直至过量,反应的实质是钡离子与碳酸根离子生成碳酸钡沉淀,而氢 氧根离子并没有参加反应,所以溶液的pH值基本不变。
氧根离子并没有参加反应,所以溶液的pH值基本不变。
【易错点】学生没有理解反应的实质,认为氢氧化钡被反应,pH值下降,一定量氢氧化钡完全反应后随着碳酸钠的加入pH值增加。错选为D.
7.右图是北京本地PM2.5来源分布图。据此,下列措施对减少PM2.5效果最不明显的是 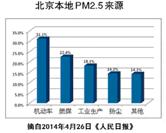
A.减少汽车的保有量
B.植树造林
C.用风能与太阳能发电替代燃煤发电
D.减少工业生产中二氧化碳的排放
【知识点】空气污染与保护、防止污染的方法
【答案】D
【考查能力】
本题主要考查列举空气污染物的主要来源;说出一些防治空气污染的方法。
【解析】
A、减少汽车的保有量,可以减少汽车尾气的排放,减少烟尘。所以A不符合题意;
B、植树造林,有利于空气的净化,部分植物可以吸附阻挡粉尘。所以B不符合题意;
C、用风能与太阳能发电替代燃煤发电,减少了烟雾粉尘的排放,所以C不符合题意;
D、减少工业生产中二氧化碳的排放,可以减缓温室效应,但与PM2.5没有什么直接关系。所以D不符合题意。
【易错点】不清楚二氧化碳目前不计入空气污染指数的项目,它与PM2.5并 没有直接的相关性。易错选为B
没有直接的相关性。易错选为B
8.(4分)小明在生活中观察到:点燃的小木棒燃烧端朝上,往往没燃尽就熄灭,而燃烧端朝下,往往不易熄灭。从燃烧的条件来看,你认 为燃烧端朝上的小木棒,没燃尽就熄灭的最主要原因是,若将小木棒事先涂油,燃烧端朝上也不易熄灭,请说明原因。 。
为燃烧端朝上的小木棒,没燃尽就熄灭的最主要原因是,若将小木棒事先涂油,燃烧端朝上也不易熄灭,请说明原因。 。
【知识点】
燃烧的条件,不同物质的着火点不同
【答案】
小木棒温度不易达到着火点
着火点较低的油燃烧产生的热量,使小木棒温度较易达到着火点
【考查能力】
说明可燃物燃烧的条件,说明常用灭火的方法和原理。
【解析】
燃烧端朝上的小木棒,使下端的木条的温度达不到木头的着火点,所以没燃尽就熄灭。
若将小木棒事先涂油,燃烧端朝上也不易熄灭,是因为着火点较低的油燃烧产生的热量,使小木棒温度较易达到着火点。
【易错点】
不能准确判断出题目中木条熄灭是因为未达到着火点还是因为氧气不足造成的。
还有学生不清楚木头和油的着火点哪个低。
9.(4分)已知某碱溶液的溶解度随温度升高而增大;温度一定时,该碱溶液的浓度越大,其碱性越强。
(1)要使该碱饱和溶液的pH升高(溶质不变),可采取的方法是 。
(2)要使该碱饱和溶液的pH降低,在下列试剂中,哪些可选择加入?
A.CO2 B.CaCO3 C.Fe(OH)3 D.CuSO4
【知识点】
影响溶解度的因素,饱和溶液与不饱和溶液的转化,物质间的反应
【答案】
(1)升高溶液温度并在该温度下蒸发溶剂
(2)AD
【考查能力】
列举影响物质溶解性的因素,了解温度对物质溶解度的影响,知道饱和与不饱和溶液的联系,区别和转化。
【解析】
(1)该碱溶液的溶解度随温度升高而增大,又因要使该碱饱和溶液的pH升高且溶质不变,所以可以升高温度,并在该温度下蒸发溶剂,使溶液的质量分数增大,使溶液的PH的增大。
(2)A,D物质分别与该碱溶液 反应,使OH——浓度下降,所以碱饱和溶液的pH降低。B不与该碱溶液反应,D不溶于水,所以不改变溶液的PH值.
【易错点】
不清楚B不会与碱溶液反应。不知道D是不溶于水。所以容易错答成B,C
10.(8分)无标签试剂瓶中的一种黑色不溶于水的固体可能是硫化铜或者是硫化亚铜。查资料可知:硫化铜(CuS)和硫化亚铜(Cu2S)在空气中灼烧分别发生下列化学反应:
灼烧 灼烧
2CuS+3O2 ==== 2CuO+2SO2 Cu2S+O2 ---------CuO+SO2 (没配平)
(1)请写出配平后的Cu2S在空气中灼烧的化学方程式。如要确定灼烧的Cu2S是否完全反应,依据的实验现象是_________________。
(2)根据这两个反应的化学方程式中固体物质的质量变化,某同学仅用天平、酒精灯、坩埚、三角架等常用仪器(无其它试剂),通过三个实验步骤鉴别出某黑色固体是硫化铜还是硫化亚铜。他的实验步骤一:用天平准确称量一定质量的待测黑色固体。
请写出后两个实验步骤:
实验步骤二:_________________
实验步骤三:_________________
【知识点】
化学方程式的配平,化学方程式的意义,
【答案】
(1)Cu2S+2O2 ==== 2CuO+SO2
不再产生刺激性气味的气体或将湿润的蓝色石蕊试纸悬于灼烧容器上方,试纸不变色(其他合理答案酌情给分)。
(2)将称量好的黑色固体分别置于坩埚中充分灼烧,冷却至室温后称量其剩余固体的质量
【考查能力】
灵活运用基础知识和基本技能,在分析和比较的基础上对化学实验的设计能力
【解析】
根据Cu2S燃烧生成的SO2,的性质作出判断,,所以不再产生刺激性气味的气体,或将湿润的蓝色石蕊试纸悬于灼烧容器上方,试纸不变色都可以。
根据CuS燃烧后固体质量减小。而Cu2S燃烧后固体质量不变的原理,写出实验步骤2将称量好的黑色固体分别置于坩埚中充分灼烧 ,步骤3冷却至室温后称量其剩余固体的质量 。
【易错点】
不清楚本实验的原理,所以 不能正确表达实验步骤。
11.(8分)小明把过量锌粒加入有盐酸的试管中,发现随着反应的进行,产生气体的速度逐渐加快,一段时间后逐渐减慢,最后停止产生气体。在反应 过程中,溶液的温度也先随之升高,最后下降到室温。于是,小明设计实验来探究“一定质量的某种金属和同体积盐酸反应快慢的影响因素”。测得实验数据如下:
过程中,溶液的温度也先随之升高,最后下降到室温。于是,小明设计实验来探究“一定质量的某种金属和同体积盐酸反应快慢的影响因素”。测得实验数据如下:
某金属与同体积盐酸溶液反应实验数据表
盐酸溶液浓度 | 反应开始时酸 溶液的温度 | 反应开始到2分钟产生的气体体积 | 反应结束共产生气体体积 |
5% | 20℃ | 10 mL | 60 mL |
10% | 20℃ | 19 mL | 118 mL |
15% | 20℃ | 28 mL | 175 mL |
5% | 35℃ | 28 mL | 60 mL |
10% | 35℃ | 72 mL | 118 mL |
15% | 35℃ | 103 mL | 175 mL |
(1)分析实验数据得出:一定质量的某种金属和同体积盐酸反应,影响金属和酸反应快慢的主要因素有 _________________、 _________________ 。
(2)可以通过比较_________________ 实验数据来确定金属和酸反应的快慢。
(3)过量锌粒加入盐酸中,反应开始的一段时间,反应速率逐渐加快,而不是逐渐减慢。请分析原因。_________________。
【知识点】
影响化学反应速率的因素
【答案】
(1)盐酸溶液浓度、反应时溶液温度
(2)反应开始到2分钟产生的气体体积(或相同时间内产生的气体体积)
(3)温度对反应速率的影响大于盐酸溶液浓度对反应速率的影响
【考查能力】
考查学生对实验数据的分析能力和表达能力,实验探究能力。
【解析】
(1)影响化学方应的因素有温度,反应物浓度,有无催化剂,接粗面积大小,从表中可得到本实验的影响反应速率的因素有盐酸溶液浓度、反应时溶液温度。
(2)可以通过比较相同时间内产生的气体体积来确定金属和酸反应的快慢。
(3)反应开始的一段时间,盐酸浓度在降低,但反应温度在上升,所以温度对反应速率的影响大于盐酸溶液浓度对反应速率的影响
【易错点】
没有对实验变量进行横向的比较,很难分析出温度对反应速率的影响大于盐酸溶液浓度对反应速率的影响。
12.(6分)2013年5月,某市自来水有股奇怪的味道,经专家多轮综合检测,基本认定引起此次异味的主要物质是邻叔丁基苯酚。将30克邻叔丁基苯酚完全燃烧,生成88克CO2和25.2克H2O(无其他产物)。已知邻叔丁基苯酚的相对分子质量为150,求:
(1)30克邻叔丁基苯酚 中含碳元素 克,氢元素 克。
中含碳元素 克,氢元素 克。
(2)邻叔丁基苯酚的化学式为 。
【知识点】质量守恒定律;化学式的计算;
【答案】
(1)24, 2.8
(2)C10H14O
【解析】
(1)根据质量守恒定律,将30克邻叔丁基苯酚完全燃烧后碳元素和氢元素的质量不变,所以88克CO2 中碳元素的质量等于30克邻叔丁基苯酚中碳元素的质量,25.2克H2O中的氢元素的质量等 于30克邻叔丁基苯酚中氢元素的质量。
于30克邻叔丁基苯酚中氢元素的质量。
m (C) =88g×12/44 =24g m (H) = 25.2×1/9=2.8g
(2)30克邻叔丁基苯酚中 m (O) = 30g-24g-2.8g=3.2g
设邻叔丁基苯酚的化学式为CxHyOz,
m (C):m (H):m (O) =12x:y :16z=24:2.8:3.2
解得:x:y:z=10:14:1
又因为邻叔丁基苯酚的相对分子质量为150,所以邻叔丁基苯酚的化学式为C10H14O。
【考查能力】
利用质量守恒定律进行分析能力;利用元素质量比求化学式的能力。
 【易错点】不清楚相对质量比等于实际质量比,不能正确列出等式计算。
【易错点】不清楚相对质量比等于实际质量比,不能正确列出等式计算。
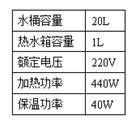
13.(10分)某家用饮水机(见右图)通过电热使水加热到95℃时,饮水机从加热状态自动切换到保温状态,如水温降到85℃时,则重新加热,使水温重新上升到95℃。如此反复,使水温始终维持在一定范围内。根据饮水机工作过程,

请你回答以下问题:
(1)若水中含有少量硝酸盐,反复加热,会使其中的部分硝酸根离子转化为亚硝酸根离子(NO2-),在此过程中氮元素的化合价如何变化?
(2)反复加热,会导致水中的溶解氧越来越少。你认为长期饮用这种水,是否会导致人体缺氧?请作出判断并说明理由。
(3)其实饮水机在加热时,并不是对整桶水进行加热的,只是对饮水机内热水箱中的那部分水加热。为了比较“切断电源8小时后一次加热至95℃”和“8小时内保温状态下反复加热”两种情况下消耗的电能多少,在没有电能表的情况下,除本题提供的信息外,还需测量哪两个或三个量?_________、_________、__________。(饮水机部分技术指标见右表)
【知识点】
元素的化合价;呼吸与呼吸运动;电功率的计算公式;
【答案】
(1)从+5到+3
(2)否 人通过呼吸运动吸入空气中的氧气
(3)水从室温上升到95℃所需的加热时间 水从85℃上升到95℃所需的加热时间
开始保温到下次加热的时间(水从室温上升到95℃所需的加热时间 8 小时内水从85℃上升
小时内水从85℃上升 到95℃的加热总时间)
到95℃的加热总时间)
【解析】
(1)根据离子求元素的化合价,
设NO3-离子中氮元素的化合价为x,则有 x+(-2)×3=-1 解得 x=+5
设NO2-离子中氮元素的化合价为x,则有 x+(-2)×2=-1 解得 x=+3
所以,氮元素的化合价从+5 到 +3.
(2)人体细胞中氧是首先通过呼吸运动进入肺,再通过气体交换到达血液,然后通过血液循环运输到组织细胞,与饮用水无关。
(3)为了比较“切断电源8小时后一次加热至95℃”和“8小时内保温状态下反复加热”两种情况下消耗的电能多少,根据W=Pt 题中已知加热功率,只要知道水从室温上升到95℃所需的加热时间就可得到“切断电源8小时后一次加热至95℃”时所消耗的电能,而只要知道水从85℃上升到95℃所需的加热时间和开始保温到下次加热的时间或8小时内水从85℃上升到95℃的加热总时间就可以求出“8小时内保温状态下反复加热”时所消耗的电能。
【考查能力】
化合价的计算能力;人体新陈代谢消化、呼吸、循环之间的关系;应用电功率的计算公式 进行分析能力。
进行分析能力。
【易错点】
不能利用电功率公式进行正确的分析;认为从85℃上升到95℃所需的加热时间和开始保温到下次加热的时间相等所以答错。


