(单词翻译:单击)
第一部分(选择题共126分)
1.稻-鸭-萍共作是一种新兴的生态农业模式,其中,水生植物红萍(调江红)适生于隐蔽环境,可作为鸭子的饲料,鸭子能吃有害昆虫并供肥。促进水稻生长,对以此模式形成的生态系统,下列叙述错误的是
A.该生态环境的主要功能物质循环和能量流动
B.鸭子既是消费者,又是次级消费者
C.生物群落由水稻,红萍,鸭子和有害昆虫组成
D.水稻和红萍分层分布,能提高光能利用率
2.下列有关细胞分化的叙述,正确的是
A.原肠胚的形成与囊胚细胞的分裂和分化直接相关
B.红细胞的形成与某种表达有关而与细胞分化无关
C.胡萝卜的细胞分化形成愈伤组织后不具全能性
D.癌细胞的产生与细胞的畸形分化无直接关系
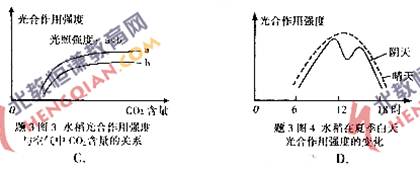
3.在题3的图中,图1图2为不同材料叶绿体中色素的层析结果(示意图),图3,图4为不同条件下水稻光合作用强度的变化曲线,其中正确的是
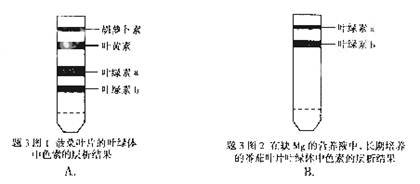
4.某成年女性因患病导致性周期停止,并出现泌乳现象,据此推断,发生病变的部位是
A.胸腺 B.垂体 C.卵巢 D.乳腺
5.结核杆菌是结核病的病因,近年来因抗药菌株增多等原因,使人类结核病的发病率和死亡率上升。下列有关结核杆菌的叙述,正确的是
A.结核杆菌的基本结构包括细胞壁,细胞膜,细胞质和细胞核
B.结核杆菌抗药性的产生是应用抗生素诱导基因突变的结果
C.接种卡介苗后,T细胞受刺激成为记忆细胞,产生相应的抗体
D.感染结核杆菌后,机体主要通过特异性细胞免疫的作用将其消灭
6.题6表是食用碘盐包装上的部分说明,下列说法正确的是
A.高温会导致碘的损失
B.碘酸钾可氧化氯化钾
C.可用淀粉检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20~50 mg/kg
题6表
配料 | 精盐、碘酸钾、抗结剂 |
碘含量 | 35±15 mg/kg |
储存方法 | 密封、避光、防潮 |
食用方法 | 烹饪时,待食品熟后加入碘盐 |
7.下列叙述正确的是
A.相同条件下,M2和O2的混合气体与等休整的N2所含原子数相等
B.等物质的量的甲基(-OH2)与羟基(-OH)所含电子数相等
C.常温常压下28 g CO与22.4 L O2所含分子数相等
D.16 g CH2与19 g NH+4所含质子数相等
8.对下列反应①NHCO,溶液与石灰水反应、②Kn2SO2溶液与稀盐酸反应、③Si与烧碱溶液反应、④Fe与稀硝酸反应,改变反应物用量,不能用同一个离子方程式表示的是
A. ①②③ B. ①②④ C. ①③④ D. ②③④
9.氧氟沙星是常用抗菌药,其结构简式如题9图所示,下列对氧氟沙星叙述错误的是
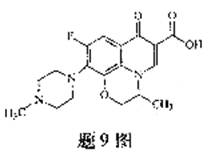
A.酸发生加成、取代反应
B.能发生还原、酯化反应
C.分子内共有19个氢原子
D.分子内共平面的碳原子多于6个
10.用食用白醋(醋酸浓度约1 mol/L)进行下列实验,能证明醋酸为弱电解质的是
A.白醋中滴入石蕊试液呈红色
B.白醋加入豆浆中有沉淀产生
C.蛋壳浸泡在白醋中有气体放出
D.pH试纸显示白醋的pH为2~3
11.如题11图所示,下列叙述正确的是
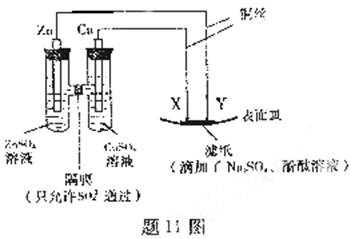
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X为滤纸接触处变红
12.用过量的H2SO4、NaOH、NH3、H2O、NaCl等溶液,按题12图所示步骤分开五种离子.则溶液①、②、③、④是
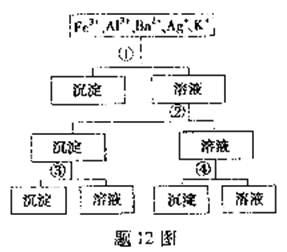
A. ①NaCl ②NaOH ③NH2·H2O ④H2SO4
B. ①H2SO4 ②NaOH ③NH3·H2O ④NaCl
C. ①H2SO4 ②NH3·H2O ③NaOH ④NaCl
D. ①NaCl ②NH3·H2O ③NaOH ④H2SO4
13.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ.且氧气中1 mol O=O键完全断裂时吸收热量496 Kj,水蒸气中1 mol H-O键形成时放出热量463 Kj,则氢气中1 mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ
C. 436 kJ D.188 kJ
14.可见光光子的能量在1.61 eV~3.10 eV范围内.若氢原子从高能级跃迁到量子数为n的低能级的谱线中有可见光,根据氢原子能级图(题14图)可判断n为


A.1 B.2 C.3 D.4
15.汽车电动机启动时车灯会瞬时变暗,如图15图,在打开车灯的情况下,电动机未启动时电流表读数为10 A,电动机启动时电流表读数为58 A,若电源电动势为12.5 V,内阻为
0.05 Ω,电流表内阻不计,则因电动机启动,车灯的电功率降低了
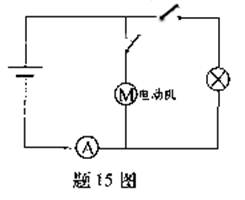
A.35.8 W B.43.2 W C.48.2 W D.76.8 W
16.如题16图,悬挂在O点的一根不可伸长的绝缘细线下端有一个带电量不变的小球A.
在两次实验中,均缓慢移动另一带同种电荷的小球B.当B到达悬点O的正下方并与A在同一水平线上,A处于受力平衡时,悬线偏离竖直方向的角度为θ,若两次实验中B的电量分别为q1和q2, θ分别为30°和45°.则q2/q1为
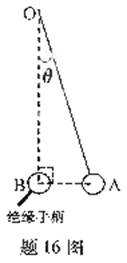
A.2 B.3 C.2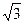 D.3
D.3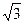
17.为估算池中睡莲叶面承受出滴撞击产生的平均压强,小明在雨天将一圆柱形水杯置于露台,测得1小时内杯中水上升了45 mm.查询得知,当时雨滴竖直下落速度约为12 m/s.据此估算该压强约为(设雨滴撞击睡莲后无反弹,不计雨滴重力,雨水的密度为1×103 kg/m3)
A.0.15 Pa B.0.54 Pa
C.1.5 Pa D.5.4 Pa
18.真空中有一平行板电容器,两极板分别由铂和钾(其极限波长分别为λ1和λ2)制成,板面积为S,间距为d.现用波长为λ(λ2<λ<λ2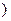 的单色光持续照射两板内表面,则电容器的最终带电量成正比
的单色光持续照射两板内表面,则电容器的最终带电量成正比
A.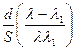 B.
B.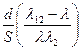
C. 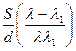 D.
D.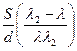
选择题二本题包括3小题,每小题6分,共18分.每小题给出的四个选项中,至少有两个选项是正确的,全部选对的得6分,选对但不全的得3分,有选错的得0分)
19.土卫十和土卫十一是土星的两颗卫星,都沿近似为圆周的轨道线土星运动.其参数如表:
卫星半径(m) | 卫星质量(kg) | 轨道半径(m) | |
土卫十 | 8.90×104 | 2.01×1018 | 1.51×1018 |
土卫十一 | 5.70×104 | 5.60×1017 | 1.51×103 |
两卫星相比土卫十
A.受土星的万有引力较大
B.绕土星的圆周运动的周期较大
C.绕土星做圆周运动的向心加速度较大
D.动能较大
20.下列说法正确的是
A.正弦交变电流的有效值是最大值的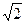 倍
倍
B.声波是织波,声源振动越快,声波传播也越快
C.在某介质中,红光折射率比其他色光的小,故红光传播速度比其他色光的大
21.氧气钢瓶充气后压强高于外界人气压,假设缓慢漏气时瓶内外温度始终相等且保持不变,氧气分子之间的相互作用.在该漏气过程中瓶内氧气
A.分子总数减少,分子总动能不变
B.密度降低,分子平均动能不变
C.吸收热量,膨胀做功
D.压强降低,不对外做功
第二部分(非选择题共174分
22.(请在答题卡上作答)(17分)
(1) 在“描绘小灯泡的伏安特性曲线”实验中.用导线a、b、c、d、e、f、g和h按题22图1所示方式连接电路,电路中所有元器件都完好,且电压表和电流表已调零.闭合开关后;
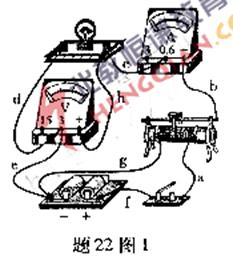
①若电压表的示数为2 V,电流表的的示数为零,小灯泡不亮,则断路的导线为_________;
②若电压表的示数为零,电流表的示数为0.3 A,小灯泡亮,则断路的导线为_________;
③若反复调节滑动变阻器,小灯泡亮度发生变化,但电压表、电流表的示数不能调为零,则断路的导线为____________.
(2)建造重庆长江大桥复线桥高将长百米、重千余吨的钢梁从江水中吊起(题22图2)、施工时采用了将钢梁与水面成一定倾角出水的起吊方案,为了探究该方案的合理性,某研究性学习小组做了两个模拟实验.研究将钢板从水下水平拉出(实验1)和以一定倾角拉出
(实验2)的过程中总拉力的变化情况.
①必要的实验器材有:钢板、细绳、水盆、水、支架、刻度尺、计时器和 等.
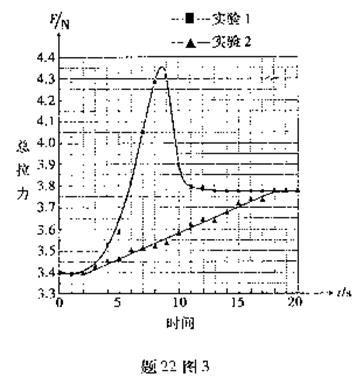
②根据实验曲线(题22图3),实验2中的最大总拉力比实验1中的最大总拉力降低了 .
③ 根据分子动理论,实验1中最大总拉力明显增大的原因是 .
④ 可能导致测量拉力的实验误差的原因有:读数不准、钢板有油污、 等等(答出两个即可)
23.(16分)t=0时,磁场在xOy平面内的分布如题23图所示.其磁感应强度的大小均为B0,方向垂直于xOy平面,相邻磁场区域的磁场方向相反.每个同向磁场区域的宽度均为l0.整个磁场以速度v沿x轴正方向匀速运动.
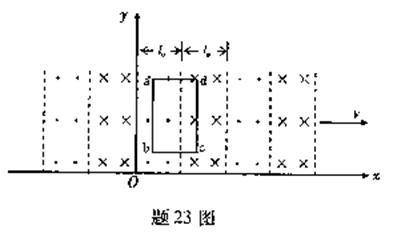
(1)若在磁场所在区间,xOy平面内放置一由a匝线圈串联而成的矩形导线框abcd,线框的bc边平行于x轴.bc=lB、ab=L,总电阻为R,线框始终保持静止.求
①线框中产生的总电动势大小和导线中的电流大小;
②线框所受安培力的大小和方向.
(2)该运动的磁场可视为沿x轴传播的波,设垂直于纸面向外的磁场方向为正,画出L=0时磁感应强度的波形图,并求波长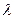 和频率f.
和频率f.
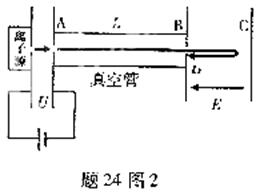
24.(9分)飞行时同质谱仪可通过测量离子飞行时间得到离子的荷质比q/m.如题24图1,带正电的离子经电压为U的电场加速后进入长度为L的真空管AB,可测得离子飞越AB所用时间L1.改进以上方法,如图24图2,让离子飞越AB后进入场强为E(方向如图)的匀强电场区域BC,在电场的作用下离子返回B端,此时,测得离子从A出发后飞行的总时间t2,(不计离子重力)
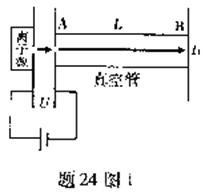
(1)忽略离子源中离子的初速度,①用t1计算荷质比;②用t2计算荷质比.
(2)离子源中相同荷质比离子的初速度不尽相同,设两个荷质比都为q/m的离子在A端的速度分别为v和v′(v≠v′),在改进后的方法中,它们飞行的总时间通常不同,存在时间差Δt.可通过调节电场E使Δt=0.求此时E的大小.
25.(20分)某兴趣小组设计了一种实验装置,用来研究碰撞问题,其模型如题25图所示不用完全相同的轻绳将N个大小相同、质量不等的小球并列悬挂于一水平杆、球间有微小间隔,从左到右,球的编号依次为1、2、3……N,球的质量依次递减,每球质量与其相邻左球质量之比为k(k<1 .将1号球向左拉起,然后由静止释放,使其与2号球碰撞,2号球再与3号球碰撞……所有碰撞皆为无机械能损失的正碰.(不计空气阻力,忽略绳的伸长,
.将1号球向左拉起,然后由静止释放,使其与2号球碰撞,2号球再与3号球碰撞……所有碰撞皆为无机械能损失的正碰.(不计空气阻力,忽略绳的伸长,
g取10 m/s2)
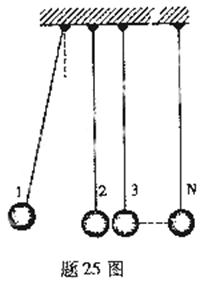
(1)设与n+1号球碰撞前,n号球的速度为vn,求n+1号球碰撞后的速度.
(2)若N=5,在1号球向左拉高h的情况下,要使5号球碰撞后升高16k(16 h小于绳长)问k值为多少?
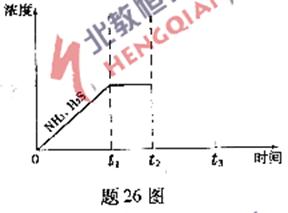
26.(14分)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源.
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为 .
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫、其电解总反应方程式(忽略氧的氧化还原)为 ;该方法的优点是 .
(3)一定温度下1 mol NH4 HS固体在定容真空容器中可部分分解为硫化氢和氨气.
①当反应达平衡时ρ氨气×p硫化氢=a(Pa2),则容器中的总压为 Pa;
②题26图是上述反应过程中生成物浓度随时间变化的示意图.若t2时增大氨气的浓度且在t3时反应再次达到平衡,诸在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线.
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
27.(16分)某兴趣小组设计出题27图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
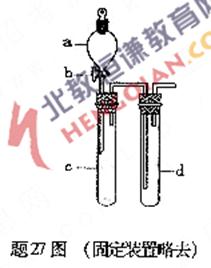
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c.其目的是 .
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸.c中反应的化学方程式是 .再由a向e中加2 mL蒸馏水,c中的实验现象是 .
(3)题27表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 .
再由a向c中加2 mL蒸馏水,c中的实验现象是 .
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2.操作步骤为 ,
实验现象为 ;但此实验的不足之处是 .
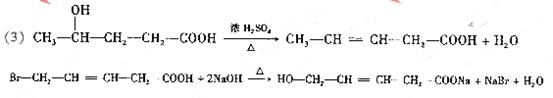
28.(16分)有机物A、B、C互为同分异构体,分子式为C5H8O2,有关的转化关系如题28图所示,已知:A的碳链无支链,且1 mol A 能与4 mol Ag(NH3)2OH完全反应;B为五元环酯.
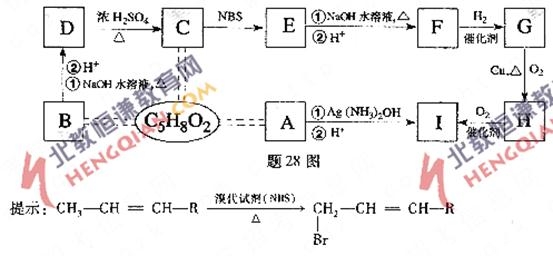
提示:
(1)A中所含官能团是 .
(2)B、H结构简式为 .
(3)写出下列反应方程式(有机物用结构简式表示)
E→C ;
E→F .
(4)F的加聚产物的结构简式为 .
29.(14分)a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与c的最外层电子数之比为2∶3,b的最外层电子数比c的最外层电子数少1个;常见化合物d2c2与水反应生成c
的单质,且溶液使酚酞试液变红.
(1)e的元素符号是 .
(2)a、b、c的氢化物稳定性顺序为(用分子式表示) ;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为 ,Z的晶体类型为 ;ab-离子的电子式为 .
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示) .
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为 .
30.(21分)李振声院士获得了2006年度国家最高科技奖,其主要成就是实现了小麦同偃麦草的远缘杂交,培合出了多个小偃麦品种.请回答下列有关小麦遗传育种的问题:
(1)如果小偃麦早熟(A)对晚熟(a)是显性,抗干热(B)对不抗干热(b)是显性(两对)基因自由组合,在研究这两对相对性状的杂交试验中,以某亲本与双隐性纯合子杂交,F1代性状分离比为1∶1,请写出此亲本可能的基因型: .
(2)如果决定小偃麦抗寒与不抗寒的一对基因在叶绿体DNA上,若以抗寒晚熟与不抗寒早熟的纯合亲本杂交,要得到抗寒早熟个体,需用表现型为 本,该纯合的抗寒早熟个体最早出现在 代.
(3)小偃麦有蓝粒品种,如果有一蓝粒小偃麦变异株,籽粒变为白粒,经检查,体细胞缺少一对染色体,这属Ⅰ染色体变异中的 变异.如果将这一变异小偃麦同正常小偃麦杂交得到的F1代自交,请分别分析F2代中出现染色体数目正常与不正常个体的原因: .
(4)除小偃麦外,我国也实现了普通小麦与黑麦的远缘杂交.
①普通小麦(六倍体)配子中的染色体数为21,配子形成时处于减数第二次分裂后期的每个细胞中的染色体数为 ;
②黑麦配子中的染色体数和染色体组数分别为7和1,则黑麦属于 倍体植物.
③普通小麦与黑麦杂交,F1代体细胞中的染色体组数为 ,由此F1代可进一步育成小黑麦.
31.(21分)甘薯和马铃薯都富含淀粉,但甘薯吃起来比马铃薯甜.为探究其原因,某兴趣小组以甘薯块茎为材料,在不同温度、其他条件相同的情况下处理30 min后测定还原糖含量.结果表明马铃薯不含还原糖,甘薯的还原糖含量见下表:
处理温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
甘薯还原糖含量(mg/g) | 22.1 | 23.3 | 25.8 | 37.6 | 40.5 | 47.4 | 54.7 | 68.9 | 45.3 | 28.6 |
(1)由表可见,温度为70 ℃时甘薯还原糖含量最高,这是因为 .
(2)马铃薯不含还原糖的原因是 .
(3)为了确认马铃薯不含还原糖的原因,请完成以下实验:
实验原理:① ;
② .
备选材料与用具:甘薯提取液(去淀粉和还原糖),马铃薯提取液(去淀粉)二苯胺试剂,芝林试剂,双缩脲试剂,质量分数为3%的淀粉溶液为3%的淀粉溶液和质量分数为3%的蔗糖溶液等.
实验步骤:
第一步:取A、B两支试管,在A管中加入甘薯提取液,B管中加入等量的马铃薯提取液.
第二步:70 ℃水浴保温5 min后,在A、B两支试管中各加入 .
第三步:70 ℃水浴保温5 min后,在A、B两支试管中各加入 .
第四步: .
实验结果: .
(4)马铃薯不含还原糖,但吃起来略带甜味,这是由于
的作用,食用马铃薯后消化分解成的葡萄糖、被小肠上皮细胞吸收后发生的代谢变化是
.
[参考答案]
第一部分
选择题一(包括18小题,每小题6分,共108分)
1.C 2.A 3.A 4.B 5.D 6.A 7.B 8.B 9.C 10.D 11.A 12.D
13.C 14.B 15.B 16.C 17.A 18.D
选择题二(包括3小题,每小题6分,共18分)
19.AD 20.CD 21.BC
第二部分(包括10小题,共174分)
22.(17分)
(1)d导线 b导线 g导线
(2) ①测力计(弹测力计、力传感器等等)
②13.3(允许误差±0.5) 0.27(允许误差±0.03)N
③分子之间存在引力,钢板与水面的接触面积大
④快速拉出、变速拉出、出水过程中角度变化、水中有油污、水面波动等等
23.(16分)
解:
(1) ①切割磁感线的速度为v,任意时刻线框中电动势大小
g=2nBvLv (1)
导线中的电流大小
I=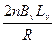 (2)
(2)
②线框所受安培力的大小和方向
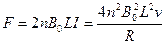
由左手定则判断,线框所受安培力的方向始终沿x轴正方向.
(2)磁感应强度的波长和频率分别为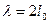 (4)
(4)
(3) 
 (5)
(5)
t=0时磁感应强度的波形图如答23图
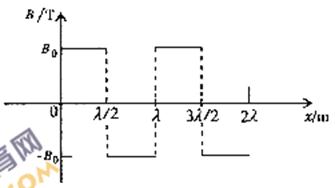
答23图
24.(19分)
解:
 (1) ①设离子带电量为q,质量为m,经电场加速后的速度为v,则
(1) ①设离子带电量为q,质量为m,经电场加速后的速度为v,则
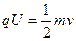 2 (1)
2 (1)
离子飞越真空管,AB做匀速直线运动,则
L=m1 (2)
由(1)、(2)两式得离子荷质比
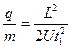 (3)
(3)
②离子在匀强电场区域BC中做往返运动,设加速度为a,则
qE=ma (4)
L2=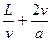 (5)
(5)
由(1)、(4)、(5)式得离子荷质比
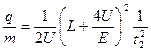 或
或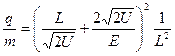 (6)
(6)
(3) 两离子初速度分别为v、v′,则
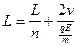 (7)
(7)
l′=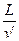 +
+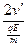 (8)
(8)
Δt=t-t′=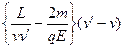 (9)
(9)
要使Δt=0,则须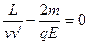 (10)
(10)
所以E=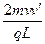 (11)
(11)
25.(20分)
解:
(1)设n号球质量为m,n+1,碰撞后的速度分别为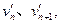 取水平向右为正方向,据题意有n号球与n+1号球碰撞前的速度分别为vn、0、mn+1
取水平向右为正方向,据题意有n号球与n+1号球碰撞前的速度分别为vn、0、mn+1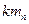
根据动量守恒,有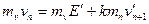 (1)
(1)
根据机械能守恒,有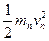 =
=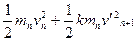 (2)
(2)
由(1)、(2)得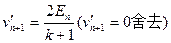
设n+1号球与n+2号球碰前的速度为En+1
据题意有vn-1=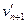
得vn-1=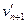 =
=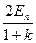 (3)
(3)
(2)设1号球摆至最低点时的速度为v1,由机械能守恒定律有
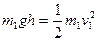 (4)
(4)
v1=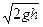 (5)
(5)
同理可求,5号球碰后瞬间的速度
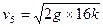 (6)
(6)
由(3)式得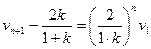 (7)
(7)
N=n=5时,v5=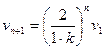 (8)
(8)
由(5)、(6)、(8)三式得
k=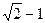
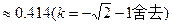 (9)
(9)
(3)设绳长为l,每个球在最低点时,细绳对球的拉力为F,由牛顿第二定律有
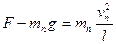 (10)
(10)
则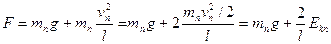 (11)
(11)
(11)式中Ekn为n号球在最低点的动能
由题意1号球的重力最大,又由机械能守恒可知1号球在最低点碰前的动能也最大,根据(11)式可判断在1号球碰前瞬间悬挂1号球细绳的张力最大,故悬挂1号球的绳最容易断.
26.(14分)
(1)2Fe2++H2S=S↓+2Fe2++2H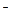
(2)Na2S+2H2O S↓+H2↑+2NaOH或S2++2H2O
S↓+H2↑+2NaOH或S2++2H2O S↓+ H2↑+2OH-
S↓+ H2↑+2OH-
副产氢气,生成的NaOH可循环利用.
(3) ①2/3
② 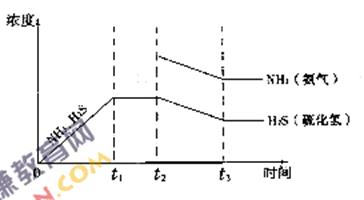
27.(16分)
(1)检查装置气密性.
(2)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
反应变缓,气体颜色变淡.
(3)丙;耗酸量最少,无污染.
(4)向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸;c中有黄绿色气体产生,d中溶液变为黄棕色;没有处理尾气.
28.(16分)
(1)醛基或-CHO
(2)
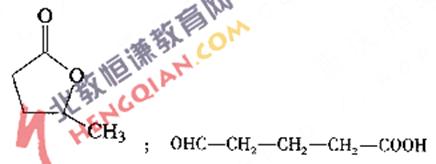
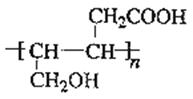 (4)
(4)
29.(14分)
(1)S
(2)CH4<NH3<H2O;共价健和离子键;离子晶体;[ ∶C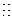 N+]-
N+]-
(3)CO2-3 +H2O=HCO-3+OH-或C7O2-4+H2O=HC2O-4+OH-
(4)0.3 mol Na2O2、0.1 mol Na2CO3
30.(21分)
(1)AaBB、Aabb、AABb、aaBb.
(2)抗寒晚熟;F2(或子二).
(3)数目.
原因:F1代通过减数分裂能产生正常与不正常的两种配子;正常配子相互结合产生正常的
F2代;不正常配子相互吉合、正常配子与不正常配子结合产生不正常的F2代.
(4)①42 ②∶ ③4.
31.(21分)
(1)还原糖的产生是酶作用的结果,酶具有最适温度.
(2)不含淀粉酶.
(3)实验原理:
①淀粉酶水解淀粉产生还原糖;
②还原糖与斐林试剂反应,产生砖红色沉淀.
实验步骤:
第二步:等量淀粉溶液.
第三步:等量斐林试剂.
第四步:沸水溶加热煮沸1-2 min.
实验结果:A管砖红色,B管蓝色.
(4)唾液淀粉酶.
代谢变化是:氧化分解为CO2、H2O及释放能量;合成糖元(肝糖元、肌糖元);转变成非糖物质(脂肪、某些非必需氨基酸).


