(单词翻译:单击)
生物部分
1.二倍体生物细胞正在进行着丝点分裂时,下列有关叙述正确的是
A.细胞中一定不存在同源染色体
B.着丝点分裂一定导致DNA数目加倍
C.染色体DNA一定由母链和子链组成
D.细胞中染色体数目一定是其体细胞的2倍
【答案】C
2.下图是细胞中糖类合成与分解过程示意图。下列叙述正确的是
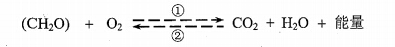
A.过程①只在线粒体中进行,过程②只在叶绿体中进行
B.过程①产生的能量全部储存在ATP中
C.过程②产生的(CH2O)中的氧全部来自H2O
D.过程①和②中均能产生[H],二者还原的物质不同
【答案】D
3.图a、b分别为农村和城市生态系统的生物量(生命物质总量)金字塔示意图。下列叙述正确的是
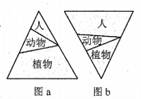
A.两个生态系统均可通过信息传递调节种间关系
B.两个生态系统的营养结构均由3个营养级组成
C.城市生态系统不具有自我调节能力,抵抗力稳定性低
D.流经两个生态系统的总能量均是其植物所固定的太阳能
【答案】A
4.为达到相应目的,必须通过分子检测的是
A.携带链霉素抗性基因受体菌的筛选
B.产生抗人白细胞介素-8抗体的杂交瘤细胞的筛选
C.转基因抗虫棉植株抗虫效果的鉴定
D.21三体综合征的诊断
【答案】B
5.MRSA菌是一种引起皮肤感染的“超级细菌”,对青霉素等多种抗生素有抗性。为研究人母乳中新发现的蛋白质H与青霉素组合使用对MRSA菌生长的影响,某兴趣小组的实验设计及结果如下表。下列说法正确的是

A.细菌死亡与否是通过光学显微镜观察其细胞核的有无来确定
B.第2组和第3组对比表明,使用低浓度的青霉素即可杀死MRSA菌
C.实验还需设计有2μg/mL青霉素做处理的对照组
D.蛋白质H有很强的杀菌作用,是一种新型抗生素
【答案】C
6.神经递质乙酰胆碱与突触后膜的乙酰胆碱受体(AChR)结合,突触后膜兴奋,引起肌肉收缩。重症肌无力患者体内该过程出现异常,其发病机理示意图如下。下列叙述错误的是
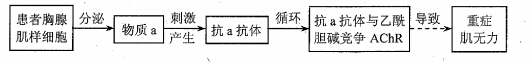
A.物质a作为抗原能激活B细胞增殖分化为浆细胞
B.抗a抗体与物质a的结合物不能被吞噬细胞清除
C.物质a引发的上述免疫过程属于体液免疫
D.患者体内乙酰胆碱与突触后膜的AChR特异性结合减少
【答案】B
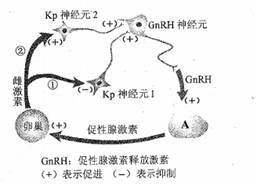
7.(16分)Kisspeptin,简称Kp,是Kp神经元产生的一类多肽类激素,它通过调节生物体内雌激素含量来调控生殖活动。
Ⅰ.通常情况下,右图中的过程①参与鹌鹑体内雌激素含量的调节:排卵前期,启动过程②进行调节。据图回答。
(1)神经元内合成Kp的细胞器是______________。Kp作用的靶细胞是____________。器官A是 ____________。
(2)在幼年期,通过过程①反馈调节,Kp释放量____________ ,最终维持较低的雌激素含量;排卵前期,启动过程②的生理意义是____________,促进排卵。
Ⅱ.Kp-10是Kp的一种。为研究Kp-10对鹌鹑产蛋的影响,对生长到20日龄的鹌鹑连续20天腹腔注射一定剂量的Kp-10,从产蛋之日起统计每日的产蛋率,结果见下图。
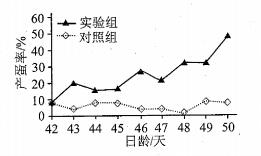
(3)据图可知,Kp-10 ____________(影响/不影响)鹌鹑开始产蛋的日龄。在50日龄内,Kp-10影响产蛋率的趋势是 ____________ 。
Ⅲ.综合分析
(4)综合Ⅰ、Ⅱ分析,推测Kp-10调控鹌鹑产蛋的方式属于____________调节。
【答案】(1)核糖体 GnRh神经元 垂体 (2)减少 通过反馈调节使Kp释放量增加,最终维持较高雌激素含量 (3)不影响 随着日龄的增加,提高产蛋率的作用逐渐增强 (4)神经—体液
(12分)嗜热土壤芽胞杆菌产生的β-葡萄糖苷酶(BglB)是一种耐热纤维素酶,为使其在工业生产中更好地应用,开展了以下试验:
Ⅰ.利用大肠杆菌表达BglB酶
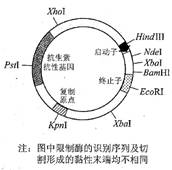
PCR扩增bglB基因时,选用____________基因组DNA作模板。
右图为质粒限制酶酶切图谱。bglB基因不含图中限制酶识别序列。为使PCR扩增的bglB基因重组进该质粒,扩增的bglB基因两端需分别引入____________和____________不同限制酶的识别序列。
大肠杆菌不能降解纤维素,但转入上述建构好的表达载体后则获得了降解纤维素的能力,这是因为 ____________。
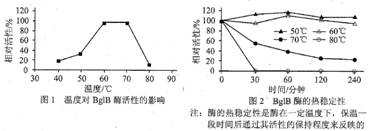
Ⅱ.温度对BglB酶活性的影响
据图1、2可知,80℃保温30分钟后,BglB酶会____________;为高效利用BglB酶降解纤维素,反应温度最好控制在____________(单选)。
A.50℃ B.60℃ C.70℃ D.80℃
Ⅲ.利用分子育种技术提高BglB酶的热稳定性
在PCR扩增bglB基因的过程中,加入诱变剂可提高bglB基因的突变率。经过筛选,可获得能表达出热稳定性高的BglB酶的基因。
与用诱变剂直接处理嗜热土壤芽胞杆菌相比,上述育种技术获得热稳定性高的BglB酶基因的效率更高,其原因是在PCR过程中 ____________(多选)。
A.仅针对bglB基因进行诱变 B.bglB基因产生了定向突变
C.bglB基因可快速累积突变 D.bglB基因突变不会导致酶的氨基酸数目改变
【答案】(1)嗜热土壤芽孢杆菌
(2)NdeⅠ BamHⅠ
(3)转基因的大肠杆菌分泌出有活性的BglB酶
(4)失活 B
(5)A、C
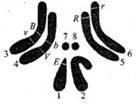
9.(16分)果蝇是遗传学研究的经典材料,其四对相对性状中红眼(E)对白眼(e)、灰身(B)对黑身(b)、长翅(V)对残翅(v)、细眼(R)对粗眼(r)为显性。下图是雄果蝇M的四对等位基因在染色体上的分布。
果蝇M眼睛的表现型是___________________________。
(2)欲测定果蝇基因组的序列,需对其中的_________条染色体进行DNA测序。
(3)果蝇M与基因型为___________的个体杂交,子代的雄果蝇既有红眼性状又有白眼性状。
(4)果蝇M产生配子时,非等位基因__________和____________不遵循自由组合规律。若果蝇M与黑身残翅个体测交,出现相同比例的灰身长翅和黑身残翅后代,则表明果蝇M在产生配子过程中_____________________________________________________,导致基因重组,产生新的性状组合。
(5)在用基因型为BBvvRRXeY和bbVVrrXEXE的有眼亲本进行杂交获取果蝇M的同时,发现了一只无眼雌果蝇。为分析无眼基因的遗传特点,将该无眼雌果蝇与果蝇M杂交,F1性状分离比如下:
F1 | 雌性﹕雄性 | 灰身﹕黑身 | 长翅﹕残翅 | 细眼﹕粗眼 | 红眼﹕白眼 |
| 1﹕1 | 3﹕1 | 3﹕1 | 3﹕1 | 3﹕1 |
| 1﹕1 | 3﹕1 | 3﹕1 | / | / |
①从实验结果推断,果蝇无眼基因位于__________号(填写图中数字)染色体上,理由是__________________________________________________________。
②以F1果蝇为材料,设计一步杂交实验判断无眼性状的显隐性。
杂交亲本:_____________________________________________________。
实验分析:
____________________________________________________________________
_______________________________________________________________。
【答案】(1)红眼细眼 (2)5 (3)XEXe
(4) B(或b) v (或V) V和v(或B和b)基因随非姐妹染色单体的交换而发生交换
(5)①7、8(或7、或8) 无眼、有眼基因与其他各对基因间的遗传均遵循自由组合定律
②示例:
杂交亲本:F1中的有眼雌雄果蝇
实验分析:若后代出现性状分离,则无眼为隐性性状;若后代不出现形状分离,则无眼为显性性状。
物理部分
单项选择(每小题6分,共30分。每小题给出的四个选项中,只有一个选项是正确的)
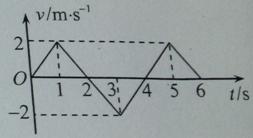
质点作直线运动的速度—时间图像如图所示,该质点( )
在第1秒末速度方向发生了改变
在第2秒末加速度方向发生了改变
在前2秒内发生的位移为零
第3秒末和第5秒的位置相同
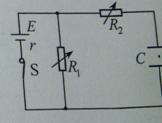
如图所示,电路中 、
、 均为可变电阻,电源内阻不能忽略,平行板电容器C的极板水平放置。闭合电建S,电路达到稳定时,带电油滴悬浮在两板之间静止不动。如果仅改变下列某一个条件,油滴仍能静止不动的是( )
均为可变电阻,电源内阻不能忽略,平行板电容器C的极板水平放置。闭合电建S,电路达到稳定时,带电油滴悬浮在两板之间静止不动。如果仅改变下列某一个条件,油滴仍能静止不动的是( )
A.增大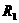 的阻值 B.增大
的阻值 B.增大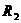 的阻值
的阻值
C.增大两板间的距离 D.断开电键S
研究表明,地球自转在逐渐变慢,3亿年前地球自转的周期约为22小时。假设这种趋势会持续下去,地球的其他条件都不变,未来人类发射的地球同步卫星与现在相比( )
A.距地球的高度变大 B.向心加速度变大
C.线速度变大 D.加速度变大
如图所示,平行金属板A、B水平正对放置,分别带等量异号电荷。一带点微粒水平射入板间,在重力和电场力共同作用下运动,轨迹如图中虚线所示,那么( )
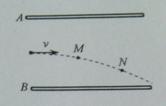
A.若微粒带正电荷,则A板一定带正电荷
B.微粒从M点运动到N点电势能一定增加
C.微粒从M点运动到N点动能一定增加
D. 微粒从M点运动到N点机械能一定增加
平衡位置处于坐标原点的波源S在y轴上振动,产生频率50HZ的简谐波向x轴正、负两个方向传播,波速均为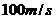 。平衡位置在x轴上的P、Q两个质点随波源振动着,P、Q的x轴坐标分别为
。平衡位置在x轴上的P、Q两个质点随波源振动着,P、Q的x轴坐标分别为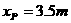 、
、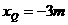 。当S位移为负且向-y方向运动时,P、Q两质点的( )
。当S位移为负且向-y方向运动时,P、Q两质点的( )
A.位移方向相同、速度方向相反 B. 位移方向相同、速度方向相同
C.位移方向相反、速度方向相反 D. 位移方向相同、速度方向相同
二、不定项选择题(每小题6分,共18分。每小题给出的四个选项中,都有多个选项是正确的。全部选对的得6分,选对但不全的得3分,选错或不答的得0分)
下列说法正确的是( )
A.玻尔对氢原子光谱的研究导致原子的核式结构模型的建立
B.可利用某些物质在紫外线照射下发射出荧光来设计防伪措施
C.天然放射现象中产生的射线都能在电场或磁场中发生偏转
D.观察者与波源互相远离时接收到波的频率与波源频率不同
如图1所示,在匀强磁场中,一矩形金属线圈两次分别以不同的转速,绕与磁感线垂直的轴匀速转动,产生的交变电动势图象如图2中曲线a、b所示,则( )
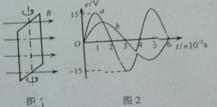
A.两次t=0时刻线圈平面与中性面重合
B.曲线a、b对应的线圈转速之比为2:3
C. 曲线a表示的交变电动势频率为25HZ
D.曲线b表示的交变电动势有效值为10V
一束由两种频率不同的单色光组成的复色光从空气射入玻璃三棱镜后,出射光分成a、b两束,如图所示,则a、b两束光( )
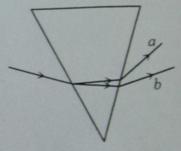
A.垂直穿过同一平板玻璃,a光所用的时间比b光长
B.从同种介质射入真空发生全反射时,a光的临界角比b光小
C.分别通过同一双缝干涉装置,b光形成的相邻亮条纹间距小
D.若照射同一金属装置都能发生光电效应,b光照射时逸出的光电子最大初动能大
9.填空(18分)
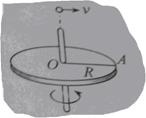
(1)半径为R的水平圆盘绕过圆心o的竖直轴转动,A为圆盘边缘上一点,在o的正上方有一个可视为质点的小球以初速度v水平抛出时,半径OA方向恰好与v的方向相同,如图所示。若小球与圆盘只碰一次,且落在A点,重力加速度为g,则小球抛出时距o的高度h=_______圆盘转动的角速度大小为
(2)某同学把附有滑轮的长木板平放在实验桌面上,将细绳一端拴在小车上,另一端绕过定滑轮,挂上适当的钩码使小车在钩码的牵引下运动,以此定量研究绳拉力做功与小车动能变化的关系。此外还准备了打点计时器及配套的电源、导线、复写纸、纸带、小木块等。组装的实验装置如图所示。
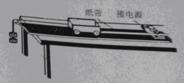
①若要完成该实验,必须的实验器材还有哪些
②实验开始时,他先调节木板上定滑轮的高度,使牵引小车的细绳与木板平行。他这样做的目的是下列的哪个 _______填字母代号
A 避免小车在运动过程中发生抖动
B 可使打点计时器在纸带上打出的点迹清晰
C 可以保证小车最终能够实现匀速直线运动
D 可在平衡摩擦力后使细绳拉力等于小车受的合力。
③平衡摩擦后,当他用多个钩码牵引小车时,发现小车运动过快,致使打出的纸带上点数太少,难以选到合适的点计算小车的速度。在保证所挂钩码数目不变的条件下,请你利用本实验的器材提出一各解决方法:________________________________
④他将钩码重力做的功当做细绳拉力做的功,经多次实验发现拉力做功总是要比小车动能增量大一些,这一情况可能是下列哪些原因造成的_____________________(填字母代号)。
A.在接通电源的同时释放了小车
B.小车释放时离打点计时器太近
C.阻力未完全被小车重力沿木板方向的分力平衡掉
D.钩码做匀加速运动,钩码重力大于细绳拉力
(3)现要测量一个未知电阻Rx的阻值,除Rx外可用的器材有:
多用的电表(仅可使用欧姆挡);
一个电池组E(电动势6V);
一个滑动变阻器R(0~20 ,额定电流1A);
,额定电流1A);
两个相同的电流表G(内阻Rg=1000 ,满偏电流Ig=100
,满偏电流Ig=100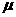 A);
A);
两个标准电阻(R1=29000 ,R2=0.1
,R2=0.1 )
)
一个电键S、导线若干。
①为了设计电路,先用多用电表的欧姆挡,粗测未知电阻,采用“×10”挡,调零后测量该电阻,发现指针偏角非常大,最后几乎紧挨满偏刻度停下来,下列判断和做法正确的是____________________(填字母代号)
A.这个电阻阻值很小,估计只有几欧姆
B.这个电阻阻值很大,估计有几千欧姆
C.如需进一步测量可换““×1”挡,调零后测量
D. 如需进一步测量可换““×1k”挡,调零后测量
②根据粗测的判断,设计一个测量电路,要求测量尽量准确并使电路能耗较小,画出实验电路图,并将各元件字母代码标在该元件的符号旁。
10.如图所示,水平地面上静止放置一辆小车A,质量mA=4kg,上表面光滑,小车与地面间的摩擦力极小,可以忽略不计。可视为质点的物块B置于A的最右端,B的质量mB=2kg.现对A施加一个水平向右的恒力F=10N,A运动一段时间后,小车左端固定的挡板与B发生碰撞,碰撞时间极短,碰后A、B粘合在一起,共同在F的作用下继续运动,碰撞后经时间t=0.6s,二者的速度达到vt=2m/s.求
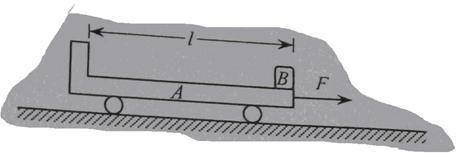
(1)A开始运动时加速度a的大小;
(2)A、B碰撞后瞬间的共同速度v的大小;
(3)A的上表面长度l
11.如图所示,两根足够长的平行金属导轨固定在倾角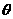 =300 的斜面上,导轨电阻不计,间距L=0.4m。导轨所在空间被分成区域I和Ⅱ,两区域的边界与斜面的交线为MN,I中的匀强磁场方向垂直斜面向下,Ⅱ中的匀强磁场方向垂直斜面向上,两磁场的磁场感应度大小均为B=0.5T,在区域I中,将质量m1=0.1kg,电阻R1=0.1
=300 的斜面上,导轨电阻不计,间距L=0.4m。导轨所在空间被分成区域I和Ⅱ,两区域的边界与斜面的交线为MN,I中的匀强磁场方向垂直斜面向下,Ⅱ中的匀强磁场方向垂直斜面向上,两磁场的磁场感应度大小均为B=0.5T,在区域I中,将质量m1=0.1kg,电阻R1=0.1
 的金属条ab放在导轨上,ab刚好不下滑。然后,在区域Ⅱ中将质量m2=0.4kg,电阻R2=0.1
的金属条ab放在导轨上,ab刚好不下滑。然后,在区域Ⅱ中将质量m2=0.4kg,电阻R2=0.1 的光滑导体棒cd置于导轨上,由静止开始下滑,cd在滑动过程中始终处于区域Ⅱ的磁场中,ab、cd始终与轨道垂直且两端与轨道保持良好接触,取g=10m/s2,问
的光滑导体棒cd置于导轨上,由静止开始下滑,cd在滑动过程中始终处于区域Ⅱ的磁场中,ab、cd始终与轨道垂直且两端与轨道保持良好接触,取g=10m/s2,问
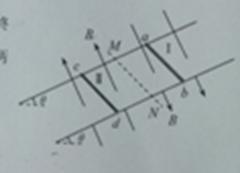
(1)cd下滑的过程中,ab中的电流方向;
(2)ab将要向上滑动时,cd的速度v多大;
(3)从cd开始下滑到ab刚要向上滑动的过程中,cd滑动的距离x=3.8m,此过程中ab上产生的热量Q是多少。
12 同步加速器在粒子物理研究中有重要的应用,其基本原理简化为如图所示的模型。M、N为两块中心开有小孔的平行金属板。质量为m、电荷量为+q的粒子A(不计重力)从M板小孔飘入板间,初速度可视为零。每当A进入板间,两板的电势差变为U,粒子到达加速,当A离开N板时,两板的电荷量均立即变为零。两板外部存在垂直纸面向里的匀强磁场,A在磁场作用下做半径为R的圆周运动,R远大于板间距离。A经电场多次加速,动能不断增大,为使R保持不变,磁场必须相应地变化。不计粒子加速时间及其做圆周运动产生的电磁辐射,不考虑磁场变化对粒子速度的影响及相对论效应。求:
(1)A运动第1周时磁场的磁感应强度B1的大小。
(2)在A运动第n周的时间内电场力做功的平均功率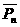
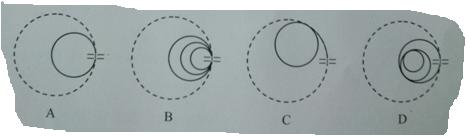
(3)若有一个质量也为m、电荷量为+kq(k为大于1的整数)的粒子B(不计重力)与A同时从M板小孔飘入板间,A、B初速度均为零,不计两者间的相互作用,除此之外,其他条件均不变。下图中虚线、实线分别表示A、B的运动轨迹。在B的轨迹半径远大于板间距离的前提下,请指出哪个图能定性地反映A、B的运动轨迹,并经推导说明理由。
参考答案:
1D2B3A4C5D6BD7AC8AB
9(1)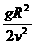 ;
;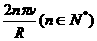
(2)①刻度尺、天平(包括砝码)②D③可在小车上加适量的砝码(或钩码)④CD
(3)①AC②限流外接;电压表和电流表均改装
10(1)2.5m/s2 (2)1 m/s (3)0.45m
11(1)a-b (2)5m/s (3)1.3J
12(1)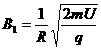 (2)
(2)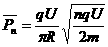 (3)图A,
(3)图A,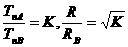
化学部分
第I卷
1.化学与生产、生活息息相关, 下列叙述错误的是
A.铁表而镀锌可以增强其抗腐蚀性
B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染
C.大量燃烧化石燃料是造成雾霾天气的一种重要因素
D.含再金属离子的电镀废液不能随意排放
2.实验室制备下列气体时,所用方法正确的是
A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置
B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体
C.制乙烯时,用排水法或向上排空气法收集气体
D.制二氧化氮时,用水或NaOH溶液吸收尾气
3.运用相关化学知识进行判断,下列结论错误的是
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
4.对右图两种化合物的结构或性质描述正确的是
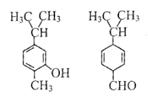
A.不是同分异构体
B.分子中共平面的碳原了数相同
C.均能与溴水反应
D.可用红外光谱区分,但不能用核磁共振氢谱区分
5.下列有关电解质溶液中粒子浓度关系正确的是
A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-)
B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-)
C.CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+ c(C2O42-)+c(H2C2O4)]
6.已知:锂离子电池的总反应为:LixC+Li1-xCoO2放电充电C+LiCoO2,锂硫电池的总反应为:2Li+S放电充电Li2S,有关上述两种电池说法正确的是
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.右图表示用锂离子电池给锂硫电池充电
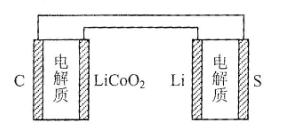
第II卷
7.(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 ___________ 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ___________,氧化性最弱的简单阳离子是___________。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___________;制铝时,电解Al2O3而不电解AlCl3的原因是___________。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
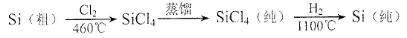
写出SiCl4的电子式:___________;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:___________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 ___________。
a. NH3 b. HI c. SO2 d . CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:___________。
8.(18分)从薄荷油中得到一种烃A(C10H16),叫ɑ—非兰烃,与A相关反应如下:
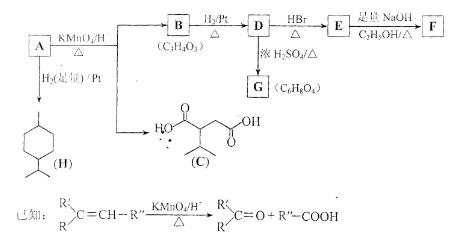
(1)H的分子式为 ___________。
(2)B所含官能团的名称为___________ 。
(3)含两个—COOCH3基团的C的同分异构体共有___________ 种(不考虑手性异构),其中核磁共振氢谱呈现2个吸收峰的异构体结构简式为 ___________。
(4)B→D,D→E的反应类型分别为___________ 、___________。
(5)G为含六元环的化合物,写出其结构简式:___________ 。
(6)F在一定条件下发生聚合反应可得到一种高级吸水性树脂,该树脂名称为___________。
(7)写出E→F的化学方程式:_________________________________ 。
(8)A的结构简式为 ___________,A与等物质的量的Br2进行加成反应的产物共有___________ 种(不考虑立体异构)。
9.(18分)Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
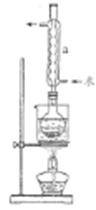
I.制备Na2S2O3•5H2O
反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3•5H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是___________。
(2)仪器a的名称是___________,其作用是___________ 。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是___________,检验是否存在该杂质的方法是___________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:___________ .
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L‾1碘的标准溶液滴定。反应原理为:2S2O32‾+I2=S4O62-+2I‾
(5)滴定至终点时,溶液颜色的变化:___________________。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为_________mL。产品的纯度为(设Na2S2O3•5H2O相对分子质量为M)_________ 。

III.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42‾,常用作脱氧剂,该反应的离子方程式为 ___________________。
10.(14分)合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g) 2NH3(g) ∆H=—92.4kJ•mol‾1,一种工业合成氨的简易流程图如下:
2NH3(g) ∆H=—92.4kJ•mol‾1,一种工业合成氨的简易流程图如下:
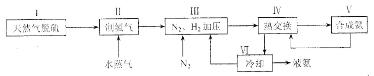
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________。
(2)步骤II中制氯气原理如下:
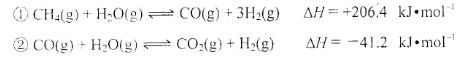
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___________________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 ___________________。
(3)图1表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:___________________。
(4)依据温度对合成氨反应的影响,在图2坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
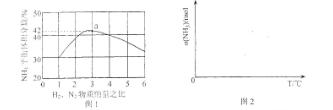
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号)___________________,简述本流程中提高合成氨原料总转化率的方法:___________________ 。

 有眼
有眼

