(单词翻译:单击)
一、选择题(本大题包括12个小题,每小题2分,共24分)每小题只有一个选项符合题意,将符合题意的选项序号填入下表相应的空格内。
1.在日常生活中发生的下列变化.其中属于化学变化的是( )
A.冰雪融化
B.瓷碗破碎
C.木柴燃烧
D.酒精挥发
2.下列物质的性质和用途关系不正确的是( )
A.金刚石的硬度大,可用于切割玻璃
B.活性炭具有吸附性,可用于脱色、除异味
C.稀有气体性质不活泼,可用于焊接金属作保护气
D.铝的化学性质稳定,可在铁栏杆的表而涂铝粉防止生锈
3.分类是学习化学的方法之一。下列各组物质是按单质、氧化物、混合物的顺序排列的是( )
A.氧气、水、空气
B.氮气、氯酸钾、钢
C.可燃冰、干冰、冰水混合物
D.石墨、熟石灰、石油
4.我国推广食用的加碘盐是在食盐中加入一定量的碘酸钾(KIO3)。在碘酸钾中碘元素的化合价为( )
A.-1 B-5. C.+1 D.+5
5.下列有关反应类型的判断错误的是( )
A.2NaHCO3△Na2CO3 +H2O+CO2↑ 分解反应
B.CaO+H2O====Ca(OH)2 化合反应
C.H2+CuO======Cu+H2O 置换反应
D.6CO2+6H2O光照叶绿体 C6H12O6+6O2 复分解反应
6.氨基酸是构成蛋白质的基石。甘氨酸是其中的一种,其化学式为C2H5O2N。下列关于甘氮甘氨酸的叙述错误的是( )
A.甘氨酸中碳元素的质量分数为32%
B.
C.甘氨酸的相对分子质量为75
D.廿氨酸中C、H、O、N四种元素的质量比为24:5:32:14
7.从环境保护的角度考虑.下列燃料最理想的是( )
A.氢气 B.天然气 C.酒精 D.汽油
8.“低碳生活”是指返璞归真地去进行人与自然的活动,要求减少生活作息时间所消耗的能量,从而减低碳的排放。下列活动不符合“低碳生活”的是( )
A.短时间不使用电脑,将其转为休眠模式
B.减少使用私家车次数,多乘公交或骑自行车
C.讲究卫生,尽量多用一次性餐具
D.用传统发条式闹钟代替电子钟
9.某同学测定的下列数据中,不合理的是( )
A.用10 mL量筒量取7.5 mL水
B.用pH试纸测得某地水的pH为5.2
C.用托盘天平称得某物质样品的质最为16.7 g
D.测得某粗盐中氯化钠的质量分数为90.5%
10.下列设计的实验方案中,不能达到目的是( )
A.用灼烧闻气味区分羊毛绒和棉线
B.用稀盐酸区分铁粉和木炭粉
C.用酚酞溶液区分稀盐酸和食盐水
D.用尝味道的方法区分厨房厨柜中调味品食盐和庶糖
11.小明同学从S+O2======SO2 中获得以下信息:①该反应中反应物是硫和氧气;②该反应发生的条件是点燃;③反应前后元素种类和原子个数保持不变;④反应前后分子总数保持不变;⑤参加反应的硫和氧气的质量比为2﹕1。其中正确的信息是( )
A.①②④⑤ B.①②③ C.④⑤ D.①②③⑤
12.某气体物质3.0 g在空气中完全燃烧,生成CO24.4 g,同时生成1.8 gH2O 。则对该物质相关判断正确的是( )
A.该物质只含碳、氢元素
B.该物质一定含有碳、氢元素,可能含有氧元素
C.该物质由碳、氢、氧元素组成
D.该物质分子中碳原子和氧原子的个数比为1﹕1
二、完成下列各题(本题包括4个小题,共17分)
13.从H、C、O、N。四种元素中,选择适当的元素,用化学式按下列要求填空。
①化石燃料,沼气的主要成分:___________
②重要的化工原料俗称苛性钠:____________
③食品工业中发酵粉成分之一的小苏打:___________
14.右图为a、b、c三种物质(均不含结晶水)的溶解度曲线,根据图示回答以下问题。
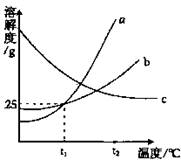
①t1℃时,a物质饱合溶液的质最分数是_______________
②t2℃时。a、b、c三种物质溶解度由大到小的顺序是__________(填写物质序号)
③将t1℃时a、b、c三种物质的饱合溶液的沮度升高到t2℃时,三种溶液的溶质质量分数大小是__________(填写物质序号)
15.硬水中含有较多的可溶性钙、镁化合物,硬水会给生活和生产带来许多麻烦。
①硬水可用_________________来区分,生活中可用________________来降低水的硬度。
②硬水在加热或久置时,会产生水垢(主要成分是Mg(OH)2 ,和CaCO3),生活中可用适量稀盐酸除去热水瓶壁上的水垢,写出有关反应的化学方程式:______________。
16.材料的发展和应用,推动了社会的进步,材料技术和应用与化学发展密不可分。铁、铜、棉花、聚乙烯塑料是人们生活和生产中常见的材料。
①上述材料中,属于天然有机高分子的是_______________;
②铁是世界上应用最广的金属,工业上炼铁是利用一氧化碳的还原性在高温下把铁从铁的矿石中还原出来。请写出一氧化碳和氧化铁在高炉中的化学反应方程式______________。
③为了探究铁和铜的金属活动性强弱,完成该实验有多种方案,写出其中一种方案中涉及化学反应方程式_______________________ 。
三、实验探究(本题包括1个小题,共9分)
17.在实验室里,常用分解过氧化氢溶液、加热氯酸钾或高锰酸钾制取氧气。某化学兴趣小组对氧气的实验室制法进行了探究。
(1)小明同学选用如图所示的装置制取氧气。制取过程中所发生的化学反应方程式为_______________________ 。
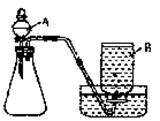
实验前,小明同学先向仪器A中加入水,然后将导气管放入水槽中,并打开仪器A的活塞,观察导气管口是否有连续的气泡出现。该实验操作的目的是______________。
(2)小红同学通过互联网得知:CuSO4 溶液、动物某些脏器中含有的物质等能催化过氧化氢的分解。
动物脏器中含有过氧化氢酶,能催化过氧化氢分解,过氧化氢酶是___________(选填糖类、蛋白质、脂肪或维生素)
实验证明,CuSO4 溶液能催化过氧化氢的分解。CuSO4溶液主要含有三种粒子(H2O、Cu2+、SO42-),为了进一步探究CuSO4溶液中哪种粒子能起催化作用。小红同学作了如下分析和设计。
①小红同学认为最不可能的是H2O,他的理由是______________。
②要说明另外的两种粒子是否起到催化作用,小红同学设计了如下实验,完成了这次探究活动。
实验步骤 | 实验现象 | 结论 |
a.取一支试管加入5 mL5%过氧化氢溶液,然后加入2~3滴稀硫酸溶液 | 溶液几乎没有气泡放出 | 实验证明,起催化作用的是___________ |
b.另取一支试管加入5 mL5%过氧化氢溶液,然后加入2~3滴_____溶液 | 溶液中有大量产泡放出 |
③如果要确定COSO4是催化剂,还必须通过实验确定它在化学反应前后______________。
四、计算题(本题包括1个小题,共5分)
18.某工厂利用废硫酸和废铁屑起反应来制取硫酸亚铁。现有废硫酸9.8 t(H2SO4的质量分数为10%)与足量的铁屑起反应,理论上可生产FeSO4的质量是多少?
参考答案:
一、选择题
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
C | D | A | D | D | B | A | C | B | C | B | C |
二、填空题(化学方程式每个2分,其余每空l分,共17分)
13.①CH4 ②NaOH ③NaHCO3
14.①20% ②a b c (或a>b>c) ③a=b<c(其它合理答案给分)
15.①肥皂水 加热煮沸(或煮沸水)
②2HCl+Mg(OH)2==== MgCl2+2H2O
CaCO3+2HCl====CaCl2+H2O+CO2↑ (方程式不分前后)
16.①棉花 ②3CO+Fe2O3======2Fe+3CO2
③Fe+H2SO4====FeSO4+H2↑(或Fe+CuSO4====FeSO4+Cu或其它合理答案均给分 )
三、实验探究(化学方程式每个2分,第(2)问和第③小题2分,其余每空1分,共9分)
17.(1)2H2O2======2H2O+O2↑ 检验装置的气密性(意思正确可给全分)
(2)蛋白质 ①过氧化氮(双氧水)是水溶液,所以H2O不是催剂
②CuCl2(氯化铜)或Ca(NO3)2 (硝酸铜) Cu2+(铜离子)
③化学性质和质量都没有发生改变(化学性质和质量,任答出1个给1分,共2分)
四、计算题(共5分)
8.解:设理论上可生产FeSO4的质最为x ……0.5分
Fe+ ==== +H2 ……2分
x==1.52 t ……2分
答:理论上可生成硫酸亚铁的质量是1.52 t。


