(单词翻译:单击)
一、 选择题(本大题16个小题,每小题3分,共48分。1-8题为化学题,9-16题为物理题)在每小题给出的四个选项中,只有一项是符合题目要求的。
1、下列属于化学变化的是( )
A、海水晒盐 B、植物光合作用 C、冰雪融化 D、玻璃破碎
2、某饮料的标签上标有水质成分如下(mg/L):硒:0.013 锶:0.0596 锌:0.00162 钙:4.69 钠:18.4。 这里的硒、锶、锌、钙、钠是指( )
A、元素 B、原子 C、分子 D、离子
3、从物质组成的角度看,与臭氧、红磷、铁属于同一类别的是 ( )
( )
A、钢 B、冰 C、 液氧 D、空气
4、下图是某化学反应的微观示意图,从图中获得的错误信息是(  )
)

A、该图表示的是一个化合反应
B、化学反应中,原子发生重新组合
C、化学反应前后,原子种类、数目保持不变
D、化学反 应中,反应物、生成物的微粒个数比为2:2:2:1
应中,反应物、生成物的微粒个数比为2:2:2:1
5、将X、Y、Z三种金属分别放入稀盐酸中,只有Y表面有气泡产生;再将X放入ZNO3溶液中,X表面有Z析出,则三种金属的活动性由强到弱的顺序是( )
A、X>Y>Z B、Y>Z>X C、Y>X>Z D、X>Z>Y
6、生活就是一堂堂生动的化学课。下列说法正确的是( )
A、土豆中富含淀粉,滴加碘液呈蓝色
B、“白色污染”就是白色物质的污染
C、人体摄入钙元素不足,会引起甲状腺肿大
D、我们每天都应当服用保健品来补充各种维生素
7、甲、乙两固体物质的溶解度曲线如图所示,下列说法正确的是( )
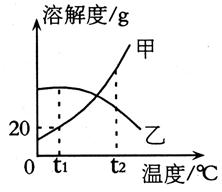
A、甲物质的溶解度为20g
B、t1℃时,30g甲加入到50g水中最多可得70g溶液
C、t2℃时,乙物质的饱和溶液升温变成不饱和溶液
D、t2℃,甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液中溶质质量分数的大小关系是:甲<乙
8、除去下列物质中的少量杂质所选用的试剂或方法正确的是( )
选项 | 物质 | 所含杂质 | 所选用试剂或方法 |
A | NaOH溶液 | Na2CO3 溶液 | 稀盐酸 |
B | CaO | CaCO3 | 高温灼烧 |
C | CO2 | CO | 点燃 |
D | 稀盐酸 | 稀硫酸 | 加适量Ba(NO3)2溶液,再过滤 |
第Ⅱ卷(非选择题共51分)
二、 填空题(本题5个小题,共26分)
填空题(本题5个小题,共26分)
17、(5分)元素周期表,是学习和研究化学的工具。下图是钙元素的相关信息。

请回答:
钙元素属于 (填“金属”或“非金属”)元素,相对原子质量为 ,其元素的原子在化学变化中容易 (填“得到”或“失去”)电子形成离子,离子符号为 ,它与氯元素形成化合物的化学式为 。
18、(4分)水是生命之源,生产之要,生活之基。今年3月22日是第二十届“世界水日”。市政府号召广大市民朋友:珍惜水、节约水、保护水。完成下列问题:
(1)饮用酸碱度过大或硬度过大的水都不利于人体健康,可用 来测定水的酸碱度。检验水是硬水还是软水,可用的物质是 ,生活中使硬水软化的常用方法是 。
(2)河水中含有许多杂质,可利用吸附、沉降、过滤、蒸馏等方法净化,其中净水程度最高的是 。
19、(5分)酸雨给人类生活和社会发展带来了严重危害。汽车尾气是导致酸雨的重要原因,为减少有害气体的排放,人们在汽车排气管上安装“催化转化器”,使尾气中的一氧化碳和一氧化氮转化为空气中体积分数最多的气体和CO2。回答下列问题:
(1)写出转化的化学方程式: 。
(2)化学反应中,元素的化合价升高,则该元素所在的反应物是还原剂,反之则为氧化剂。那么上述反应中的NO是 剂。
(3)上述反应产生的CO2大量排放会导致 ,植树造林、低碳环保刻不容缓。
(4)实验室,若要充分吸收大量的CO2,下列试剂中最合适的是 。
A、水 B、澄清石灰水 C、 饱和氢氧化钠溶液
20、(5分)A~G均为初中化学中常见的物质:其中A、C组成元素相同,E是红色单质。下图是它们之间的转化关系,请回答:
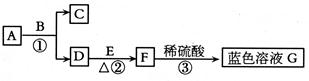
(1)写出反应①的化学方程式 ,其中B物质在该反应中起 作用。
(2)反应②中的现象为 。
(3)反应③的基本类型是 反应。
21、(7分)“上得了厅堂,下得了厨房,爬得了高山,涉得了水塘,制得成酸奶,压得成胶囊,2012,皮鞋很忙!”这是网民们在调侃工业明胶变药用胶囊。业内人士透露,“臭皮鞋”摇身一变成为亮晶晶的“食用明胶”的加工流程:
①生石灰加水浸泡;②多次清洗;③盐酸浸泡;④熬煮融胶;⑤冷却漂白;⑥晾晒粉碎。在鞣制的过程中使用了铬鞣剂,导致工业明胶的铬含量十分高,而所有铬的化合物都有毒性。其中,常用的铬鞣剂为商品铬盐精,有效成分是碱式硫酸铬,其化学式为Cr(OH)SO4。请完成下列各题:
(1)Cr(OH)SO4中Cr元素的化合价为 ;该化合物由 种元素组成,其中硫、氧元素的质量比为 。
(2)写出加工流程中生石灰与水反应、盐酸中和氢氧化钙溶液的化学方程式: ; 。
三、实验探究题(本题2个小题,共18分)
22、(8分)草木灰是一种常见的农家肥料,其主要成分是碳酸钾(K2CO3);硫酸铵[(NH4)2SO4]是一种氮肥。为了给农民朋友提供技术指导,小明对这两种肥料作了相关性质的探究。
【友情提示】:碳酸钾与纯碱具有相似的化学性质;
【实验探究】:并完成以下各题
探究过程 | K2CO3 | (NH4)2SO4 | 结论及化学方程式 |
①、分别取碳酸钾和硫酸铵固体,加足量水搅拌,测其温度变化情况 |
得到澄清溶液; 温度无明显变化 |
得到澄清溶液; 温度明显降低 |
都易溶于水; 硫酸铵溶于水时吸收的热量大于放出的热量。 |
②、取①中溶液分别滴入紫色石蕊试液,观察溶液颜色变化,并判断其酸碱性 |
变红 |
碳酸钾溶液显 性 硫酸铵溶液显 性 | |
③、另取①中溶液分别加入足量稀盐酸,观察现象 |
无明显现象 |
写出相关反应的化学方程式:
| |
④、再取①中溶液分别加入Ba(OH)2溶液,观察现象 |
产生 白色沉淀 | (NH4)2SO4与Ba(OH)2溶液反应的化学方程式: (NH4)2SO4+Ba(OH)2=BaSO4↓ +2H2O+2NH3↑ |
【交流共享】 :①、硫酸铵不宜长期使用,易造成土壤酸化而板结;草木灰的使用既实现了变废为宝,还起到了改良酸性土壤的作用;
:①、硫酸铵不宜长期使用,易造成土壤酸化而板结;草木灰的使用既实现了变废为宝,还起到了改良酸性土壤的作用;
②、草木灰和硫酸铵能否混合使用?(填“能"或“否”)
【知识拓展】:若要鉴别失去标签的碳酸钾和硫酸铵固体,下列试剂不可用的是: 。
A、水 B、稀盐酸 C、氯化钡溶液 D、无色酚酞试液
23.(10分)达州盛产天然气,有“中国气都”之称的美誉。天然气的主要成分是甲烷(CH4),我校化学兴趣小组的同学对甲烷燃烧的产物产生了兴趣,请你参与:
【提出问题】:甲烷燃烧后生成哪些物质?
【查阅资料】:含碳元素的物质完全燃烧生成CO2,不完全燃烧生成CO;无水CuSO4遇水变蓝。
【猜想与假设】: 甲 CO2 H2O ; 乙 CO H2O;
丙 NH3 CO2 H2O; 丁 CO2 CO H2O 。
你认为 同学的猜想是错误的,理由是 。
【实验探究】:为了验证上述猜想与假设,将甲烷在一定量的O2中燃烧的产物依次通过下列装置:
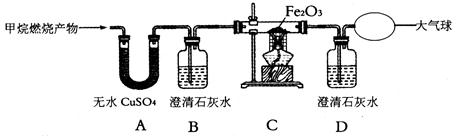
(1)A、B装置的顺序能否颠倒?(填“能"或“否”) 。
(2)实验中用纯净O2而不用空气的原因是 。
(3)实验中观察到A中无水C uSO4变蓝,B、D中澄清石灰水变浑浊,C中红色粉末变成黑色,由此推断 同学猜想成立。
uSO4变蓝,B、D中澄清石灰水变浑浊,C中红色粉末变成黑色,由此推断 同学猜想成立。
(4)请写出B中澄清石灰水变浑浊、C中红色粉末变成黑色的化学方程式: 、 。
【反思与交流】:为避免有毒的CO污染环境,所以含碳元素的物质燃烧必须满足的条件是 。
四、计算题(本题1个小题,共7分)
24、(7分)某同学为了测定NaCl和MgCl2固体混合物中MgCl2的质量分数,进行如下实验:将80g固体混合物溶于水配成溶液,平均分成四份,分别加入相同质量分数的NaOH溶液,获得如下实验数据:
实验次数 | 一 | 二 | 三 | 四 |
固体混合 | 20 | 20 | 20 | 20 |
加入NaOH溶液的质量(g) | 20 | 40 | 60 | 80 |
生成沉淀的质量(g) | 2.9 | m | 8.7 | 8.7 |
问:
(1)表中m的值为 ;(2分)
(2)原固体混合物中MgCl2的质量分数是多少?(5分)(要求写出计算过程)
达州市2012年高中阶段教育学校招生统一考试
化学参考答案及评分意见
第Ⅰ卷(选择题 共24分)
一、选择题(每小题3分,共24分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
答案 | B | A | C | D | C | A | D | B |
第Ⅱ卷(非选择题 共51分)
二、填空题(本题5个小题,共26分)
17. 金属 40.08 失去 Ca2+ CaCl2 (每空1分) 共5分
18.(1)PH试纸(PH计) 肥皂水 煮沸(加热或加热煮沸)(每空1分)
(2)蒸馏 (1分)
共4分
19.(1)2CO+2NO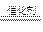 N2+2CO2 (2分)
N2+2CO2 (2分)
(2)氧化 (1分)
(3)温室效应 (1分)
 (4) C (1分)
(4) C (1分)
共5分
20.(1) 2H2O2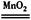 2H2O+O2↑ (2分)
2H2O+O2↑ (2分)
催化 (1分)
(2) 红色固体变黑 (1分)
(3) 复分解 (1分)
共5分
21.(1)+3 4 2:5 (每空1分,共3分)
(2)CaO+H2O=Ca(OH)2 (2分)
Ca(OH)2+2HCl=CaCl2+2H2O (2分)
 共7分
共7分
三、实验探究题(本题2个小题,共18分)
22.【实验探究】② 变蓝 (1分)
碱,酸  (答对一点得0.5分,共1分)
(答对一点得0.5分,共1分)
③ 产生大量气泡 (1分)
2HCl+K2CO3=2KCl+CO2↑+H2O (2分)
④ 产生白色沉淀、有刺激性气味的气体生成(答对一点得0.5分,共1分)
【交流共享】 否 (1分)
【知识拓展】 C (1分)
共8分
23.【猜想与假设】 丙 (1分)
质量守恒定律或化学反应前后元素的种类不变或反应前不含氮元素
(1分)
【实验探究 】(1)否 (1分)
(2)空气中含有CO2 和H2O(干扰对产物的鉴别)(1分)
(3)丁 (1分)
(4) CO2+Ca(OH)2=CaCO3↓+H2O (2分)
Fe2O3+3CO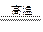 2Fe+3CO2 (2分)
2Fe+3CO2 (2分)
【反思与交流】 氧气充足 (1分)
共10分
四、计算题(本题1个小题,共7分)
(1)5.8  (2分)
(2分)
(2)解:设原固体混合物中MgCl2的质量为x
MgCl2 + 2NaOH==Mg(OH)2↓ + 2NaCl (2分)
95 58
x 8.7g (1分)
95:58=x:8.7g
x=14.25g (1分)
原固体混合物中MgCl2的质量分数为:
14.25g/20g×100%=71.25% (1分)
答:原固体混合物中MgCl2的质量分数为71.25% 共7分

 物的质量(g)
物的质量(g)
