(单词翻译:单击)
六、选择题(共20分)
27.拉瓦锡用汞进行实验,发现了空气的组成。汞的元素符号是( )
A.Ag B.He C.Hg D.Mg
28.物质在不断地运动变化,属于物理变化的是( )
A.冰雪消融 B.大米酿酒 C.木柴燃烧 D.铁钉生锈
29.下列不属于化学研究对象的是( )
A.水的电解 B.水的浮力 C.水的分子结构 D.水的元素组成
30.向pH=11的溶液中滴加石蕊试剂,溶液呈( )
A.无色 B.紫色 C.红色 D.蓝色
31.含有+2价氮元素的物质是( )
A.N2O B.NO C.NO2 D.N2O5
32.定向爆破常伴有反应:2Al+Fe2O3 Al2O3+2Fe,此反应中还原剂是( )
Al2O3+2Fe,此反应中还原剂是( )
A.Al B.Fe C.Fe2O3 D.Al2O3
33.某矿石样本含有如右图所示的四种元素,该矿石中可能含有的物质是( )
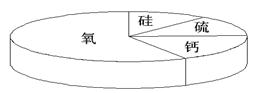
A.CaCl2 B.SiO2 C.H2O D.Fe2O3
34.物质的名称和俗名对应正确的是( )
A.碳60——石墨 B.氢氧化钾——纯碱 C.氯化钠——食盐 D.硝酸钾——草木灰
35.溶洞中存在的反应:CaCO3+CO2+H2O→Ca(HCO3)2此反应属于( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
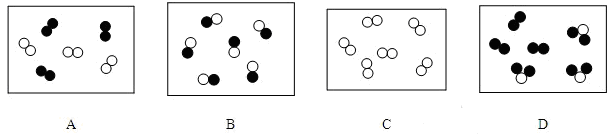
36.“○”和“●”表示不同元素的原子,以下图示表示单质的是( )
37.酒精灯的火焰太小时,将灯芯拔得松散些,可使火焰更旺。其原理是( )
A.降低可燃物的着火点 B.提高可燃物的着火点
C.增加空气中氧气含量 D.增大可燃物与空气的接触面积
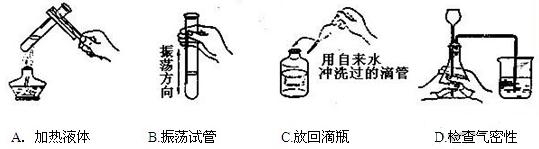
38.图示实验操作正确的是( )
39.物质的用途与利用的性质对应关系正确的是( )
A | B | C | D | |
物质 | 氧化钙 | 盐酸 | 氩气 | 金刚石 |
用途 | 干燥剂 | 除铁锈 | 保护气 | 切割玻璃 |
性质 | 能与水反应 | 挥发性 | 通电后能发出有色光 | 稳定性 |
40.用锌从含有硝酸银的废液中回收银,正确的化学方程式是( )
A.Zn+Ag(NO3)2→Ag+Zn(NO3)2 B.Zn+AgNO3→Ag+ZnNO3
C.Zn+2AgNO3→2Ag+Zn(NO3)2 D.Zn+AgNO3→Ag+Zn(NO3)2
41.下列有关SO2的叙述正确的是( )
A.SO 2的摩尔质量是64g
2的摩尔质量是64g
B.1mol SO2中含有1mol O2
C.SO2的物质的量是指SO2的质量
D.SO2中氧原子与硫原子的物质的量之比大于它们的质量比。
42.在盛有稀硫酸的烧杯中,分别加入下列物质,最终只存在无色液体的是( )
A.BaCl2溶液、NaOH溶液 B.Na2CO3溶液、KOH溶液
C.Fe2(SO4)3溶液、NaNO3溶液 D.Cu片、Na2SO4溶液
43.以下是几个常见实验的注意事项:
①在试 管中加热胆矾,试管口要略低于试管底部
管中加热胆矾,试管口要略低于试管底部
②铁丝在氧气中燃烧,集气瓶中要预先放入少量水
③氯酸钾制氧气实验完毕,先将导管移出水槽再停止加热
它们的目的都是为了防止( )
A.水倒流 B.温度过高 C.容器破裂 D.反应过慢
44.一定温度下,向右图所示烧杯中加入一定量水,仅有部分晶体溶解。所得溶液与原溶液相比,说法正确的是( )
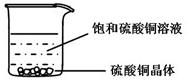
A.溶剂的质量增加,溶液颜色变浅
B.溶质溶解度不变,溶液颜色变深
C.溶质的质量增加,溶液颜色变深
D.溶质溶解度不变,溶液颜色不变
45.在隔绝空气情况下,用木炭还原氧化铜。下列叙述正确的是( )
A.反应前后固体中氧原子的物质的量保持不变
B.反应后固体减轻的质量等于氧化铜中氧元素的质量 
C.反应中消耗的氧化铜与碳的物质的量一定相等
D.反应中铜元素在固体中的质量分数逐渐变大
46.取一定量的氧化铁与氧化铜的混合物,加入稀硫酸(含0.1mol H2SO4),恰好完全反应生成盐和水。原混合物中氧元素的质量是( )
A.6.4g B.3.2g C.1.6g D.0.8g
七、填空题(共20分)
47.“化学——我们的生活,我们的未来。”
①“化学使天更蓝,水更清。”汽车尾气处理装置能使某些有毒气体转化为无毒气体:
2NO+2CO→N2+2CO2。该反应涉及的物质中,________在空气中含量最高,________是光合作用的原料,能与血红蛋白结合的是________。竹子可加工成具有吸附作用的物质,其作用与实验室中常用的________(填物质名称)相似。
②“化学为人类提供动力。”氢能属于绿色能源,氢气燃烧的化学方程式是______________。可燃冰是一种新型能源,在我国南海储量很高。其主要成分为甲烷(CH4),甲烷属于________(填“无机物”或“有机物”)。
③“化学为生命密码解锁。”DNA承载着生命遗传密码,胞嘧啶(C4H5ON3)是DNA水解产物之一。胞嘧啶由_________种元素组成,6.02×1024个C4H5ON3分子的物质的量是________mol。
48.溶解度可表示物质溶解性的大小。
①右下图是甲、乙 、丙三种固体物质(均不含结晶水)的溶解度曲线。
、丙三种固体物质(均不含结晶水)的溶解度曲线。
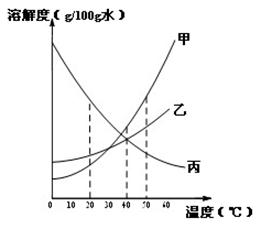
Ⅰ.20℃时,甲的溶解度________(填“>”、“<”或“=”)乙的溶解度。
Ⅱ.40℃时,乙和丙________(填“能”或“不能”)形成溶质质量分数相同的饱和溶液。
Ⅲ.20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃。请填写下表。
烧杯中的溶质 | 烧杯中固体的变化 |
甲 | __________________ |
乙 | 固体逐渐减少至全部溶解 |
丙 | __________________ |
②气体的溶解度也有一定的变化规律。
Ⅰ.打开可乐瓶,逸出大量气泡。由此可见,压强越小,CO2的溶解度越_________。为增大CO2的溶解度,可采用的一种方法是________。
Ⅱ.不同温度下,氧气的溶解度随压强的变化如右图所示,图中t1对应的温度为40℃,则t2对应的温度________(填编号)。
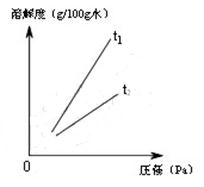
a.大于40℃ b.小于40℃ c.无法确定
49.某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
①为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比实验:
Ⅰ.将3.0g KClO3与1.0g MnO2均匀混合加热
Ⅱ.将x g KClO3与1.0g CuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢。
Ⅰ中反应的化学方程式是________;Ⅱ中x的值应为________。
②乙探究了影响双氧水分解速度的某种因素。实验数据记录如下:
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9 mL |
Ⅱ | 50.0g | 2% | 0.1g | 16 mL |
Ⅲ | 50.0g | 4% | 0.1g | 31 mL |
本实验中,测量O2体积的装置是________(填编号)。
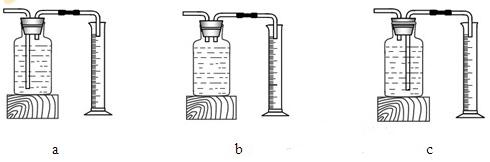
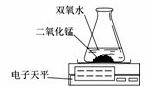
实验结论:在相同条件下,_______________,双氧水分解得越快。丙用右图装置进行实验,通过比较____________也能达到实验目的。
八、简答题(共20分)
请根据要求在答题纸相应的位置作答。
50.取10g某氯化钠溶液,滴入足量硝酸银溶液,得到0.02mol白色沉淀。
①计算该氯化钠溶液的溶质质量分数(根据化学方程式列式计算)。________
②用15%的氯化钠溶液浸泡瓜果片刻可以起到消毒作用。要使①中氯化钠溶液的溶质质量分数变为15%,可向其中加入一定量的________(填“氯化钠”或“水”)。
51.某氯化钾样品含有杂质氯化钙和氯化镁,实验室提纯流程如下:
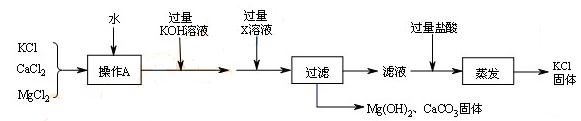
①操作A的目的是使样品________。X溶液中溶质是________。
②过滤时用到的玻璃仪器有漏斗、________、________。实验过程中发现过滤速度较慢,可能的原因是固体颗粒阻碍了液体通过滤纸孔隙,还可能是________________。
③本实验中蒸发是为了除去________(填化学式)。取所得KCl固体进行焰色反应,透过蓝色钴玻璃,观察到火焰呈________色。
④若样品中含80g KCl,理论上最终所得KCl固体的质量________(填编号)。
a.大于80g b.等于80g c.小于80g d.无法确定
52.某混合气体可能含有CO、H2、CO2和H2O(气)中的一种或几种。为验证其组成,同学们进行实验的装置和现象如下(夹持仪器已省略,假设气体均吸收完全):
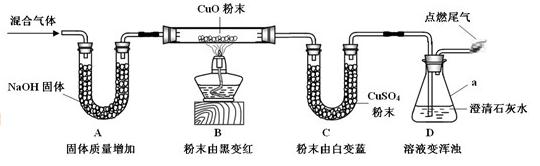
结论 | 甲 | 乙 | 丙 |
含有CO、H2、H2O(气) | 含有CO、H2、CO2 | 含有CO、H2、CO2、H2O(气) |
①仪器a的名称是________。
②装置D 中溶液变浑浊的化学方程式是________________。点燃尾气,火焰呈________色。
③丁认为,由于他们对装置________(填编号)中的实验现象分析不同而导致结论有差异。根据碳酸盐可转变为CO2的性质,丁利用上述实验结束后装置内药品和某种常见试剂进行实验,证明了甲的结论是正确的。请写出丁的实验操作过程与现象________。
参考答案
六、(共20分)
题号 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 |
答案 | C | A | B | D | B | A | B | C | A | C |
题号 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 |
答案 | D | A | A | C | D | B | C | D | D | C |
七、(共20分)
47.①N2 CO2 CO 活性炭
②2H2+O2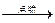 2H2O 有机物
2H2O 有机物
③4 10
48.①< 能 固体逐渐减少,至全部溶解 固体逐渐增加
②小 降温(或加压) a
49.①2KClO3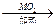 2KCl+3O2↑ 3.0
2KCl+3O2↑ 3.0
②C 双氧水浓度越大 相同时间天平读数差值大小(其它合理也可)
八、(共20分)
50.①设溶液中氯化钠的物质的量为x mol
NaCl+AgNO3→AgCl↓+NaNO3
1 1
x 0.02
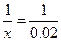 解得x=0.02mol m(NaCl)=0.02mol×58.5g/mol=1.17g
解得x=0.02mol m(NaCl)=0.02mol×58.5g/mol=1.17g
溶液中氯化钠的质量分数为: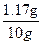 ×100%=11.7%
×100%=11.7%
②氯化钠
51.①充分溶解 K2CO3
②烧杯 玻璃棒 滤纸没有紧贴漏斗内壁,中间留有气泡(或漏斗下端尖口没紧靠烧杯内壁,或滤纸选择的规格不对等,合理即可)
③HCl、H2O 紫
④a
52.①锥形瓶
②CO2+Ca(OH)2→CaCO3↓+H2O 蓝
③A 将A中固体取出,加入烧杯(试管)中,加入过量稀盐酸,无明显现象


