(单词翻译:单击)
一、选择题:(选出其中唯一正确的答案,1--11每题2分,12、13每题3分)。
1.下列关于物质的描述中属于物理性质的是( )
A.纸张能燃烧 B.木炭能还原氧化铜
C.氧气能支持燃烧 D.硼酸在通常状况下能溶于水
2.在空气中敞口放置的一瓶酒精,没有燃烧的原因是( )
A.酒精是液体 B.酒精挥发的太快
C.没有与氧气接触 D.温度没有达到着火点
3.分类是学习和研究物质的一种常用方法.下列关于物质分类的叙述正确的是( )
A.氢气中只含有氢元素,属于单质
B.氯酸钾中含有氧元素,属于氧化物
C.碳酸中含有碳元素,属于有机物
D.碳酸钠中有碳酸根离子,属于酸
4.用分子的观点解释下列现象,不合理的是( )
A.热胀冷缩---分子间隔发生改变 B.花香四溢---分子在不断地运动
C.汽油挥发---分子大小发生变化 D.食物变质---分子本身发生变化
5.根据化学方程式不能获得的信息是( )
A.化学反应的快慢
B.该反应中的反应物和生成物
C.反应发生所需要的条件
D.各反应物和生成物的质量比
6.下列实验操作和事故处理中,正确的是( )
A.制取气体时,先装药品后检查装置的气密性
B.为了节约药品,把实验后剩余的药品放回原瓶
C.酒精灯洒出的酒精万一在桌上着火,应立即用湿布盖灭
D.碱溶液沾到皮肤上,应立即用抹布擦拭干净,再涂上稀盐酸
7.图中“ ”、“
”、“ ”代表不同元素的原子,则图中所示的微观变化过程表示的化学反应属于( )
”代表不同元素的原子,则图中所示的微观变化过程表示的化学反应属于( )

A.化合反应 B.分解反应 C.置换反应 D.复分解反应
8.在20℃时,从200g饱和硝酸钾溶液中取出5g溶液,剩余的溶液与原溶液比较,下列有关量中没有变化的是( )
①溶质的质量②溶剂的质量③溶液的密度④溶质的质量分数.
A.①② B.③④ C.②③ D.①④
9.化学物质在生产、生活中有着广泛的应用.下列说法正确的是( )
A.使用有机合成材料不会对环境造成影响
B.农业上为了提高粮食产量,应大量使用化肥、农药
C.湖水经沉淀、过滤、吸附等净化处理后,即可得到纯水
D.汽车使用压缩天然气(CNG)作燃料,会减少对环境的污染
10.下列各组气体中均能用固体氢氧化钠干燥的一组是( )
A.H2、O2、HCl B.H2、O2、CO C.H2、SO2、CO D.O2、CO、C02
11.向100g20%的氯化钠溶液中加入100g水,稀释后溶液中溶质的质量分数是( )
A.2.5% B.5% C.10% D.20%
12.下表某同学对一些知识的归纳总结,其中有错误的是( )
物质名称 | 相同点 | 不同点 | |
A | 金刚石与石墨 | 常温下化学性质不活泼 | 原子排列方式不同,用途不同 |
B | 不锈钢与焊锡 | 都是合金 | 主要成分和性质不同 |
C | 浓硫酸和浓盐酸 | 都是化合物 | 浓硫酸有吸水性,浓盐酸易挥发 |
D | 棉花和羊毛 | 都属于天然纤维 | 燃烧现象不同 |
A.A B.B C.C D.D
13.下列有关物质的区分、提纯、检验、分离所用的试剂或方法错误的是(  )
)
A.区分硝酸铵与磷矿粉---观察外观B.除去生石灰中含有的杂质石灰石---水或稀盐酸
C.检验长期露置的氢氧化钠溶液是否变质---稀盐酸或澄清石灰水
D.从过氧化氢溶液制氧气的残余物中分离出二氧化锰---过滤或蒸发
二、填空:(共13分)
14.写出下列化学符号中“2”的含义:
(1)2H ;(2)H2O ;
-2
(3)Mg2+ ;(4)CaO
15.甲醛(HCHO)是一种无色、具有强烈刺激性气味的气体,易溶于水.甲醛水溶液广泛应用于医疗卫生等行业.最近媒体曝出某些不法商贩用甲醛水溶液给大白菜保鲜,人食用喷有甲醛水溶液的大白菜后,会出现呼吸道水肿,头痛,严重的可导致白血病,根据以上信息回答:
(1)甲醛由 种元素组成;甲醛中各元素的质量比为 .
(2)为了防止大白菜中万一喷有甲醛水溶液危害人体健康,食用大白菜前应该采取的措施是 (写一条).
16.酸和碱能发生中和反应,生成盐和水.
已知甲、乙分别是盐酸和氢氧化钠溶液中的一种,图中表示向甲中加入乙时溶液pH的变化曲线,请你写出图中所获取的信息
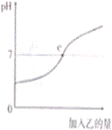
(1) ;(2) ;
(3) ;(4)  。
。
三、应用(共14分)
17.铝、铁、铜是我们生活中常见的金属.
(1)铝的利用比铜、铁晚是因为金属大规模开发和利用的先后顺序与 有关(填字母)
A.金属的活动性 B.金属的导电性 C.金属在底壳中的含量
(2)铝具有很好的抗腐蚀性能,原因是 。
(3)每年全世界钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失,铁在空气中锈蚀,实际上是铁跟 和 共同作用的结果;防止铁生锈的方法是  (写一种);焊接铁制品时,通常先用稀盐酸除去其表面的铁锈,反应的化学方程式为 ;
(写一种);焊接铁制品时,通常先用稀盐酸除去其表面的铁锈,反应的化学方程式为 ;
(4)印发铜制电路板的“腐蚀性”为FeCl3溶液反应,化学方程式分别为①Cu+2 FeCl3=2 FeCl2+CuCl2;②Fe+2 FeCl3=3X.则②中X的化学式为
18.碳酸钙是牙膏中一种常用的摩擦剂,可用石灰水作原料来制备,某工厂为了测定一批石灰石中所含碳酸钙的质量分数,称取1000g石灰石中样品,磨成粉末后,放在电炉上高温煅烧至质量不再发生变化,冷却,称量剩余固体的质量为648g。已知反应的化学方程式为:CaCO3  CaO + CO2 ↑,样品中的杂质不参加反应,据此计算:
CaO + CO2 ↑,样品中的杂质不参加反应,据此计算:
(1)生成二氧化碳的质量.
(2)石灰石样品中碳酸钙的质量分数.
四、实验探究(共20分)
19.实验室里现有氯酸钾、二氧化锰、稀硫酸、石灰石和稀盐酸以及下列仪器:
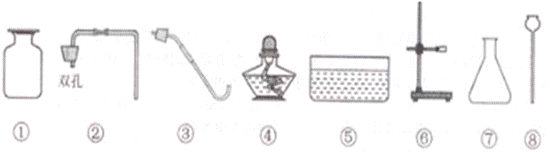
(1)利用上述仪器和药品可以制取二氧化碳,你选择的仪器是 (填序号),药品是 ,反应的化学方程式是 .
(2)若补充一种仪器 (填仪器名称),再利用上述仪器和药品还可以制取氧气,你选择的仪器是 (填序号),反应的化学方程式是 .
(3)确定气体收集装置应考虑的因素是 和 .
20.某学习小组的同学在做碳酸钠溶液和澄清石灰水反应的实验后,将反应后的浑浊液进行过滤,得到澄清的滤液,对于滤液的组成同学们做出如下猜想:
【猜想与假设】大家一致认为滤液中一定有氢氧化钠,生成氢氧化钠的化学方程式是
;小明猜想还可能有氢氧化钙,小丽猜想还可能有氢氧化钙和碳酸钠,你还能做出的猜想是 .
【活动与探究 】请你设计一个实验方案验证你的猜想.
】请你设计一个实验方案验证你的猜想.
实验步骤 | 实验现象 | 实验结论 |
【反思与提高】请你总结归纳出碳酸钠的两条化学性质:
(1) ;(2) .
参考答案
1.D 2.D 3.A 4.C 5.A 6.C 7.A 8.B 9.D 10.B 11.C 12.C 13.B
14.(1)两个氢原子(2)一个水分子中含有两个氢原子(3)一个镁离子带两个单位的正电荷(4)氧化钙中,氧元素的化合价是负二价
15.(1)3 6:1:8(2)用水多次冲洗
16.(1)甲是盐酸(2)乙是氢氧化钠溶液(3)c点表示两溶液恰好中和,c点的pH为7(4)反应前溶液的pH小于7,随着乙溶液的加入,溶液的pH逐渐增大(合理均可)
17.(1)A(2)铝与氧气反应,在其表面生成一层致密的氧化铝薄膜 ,从而阻止铝进一步被氧化(3)氧气 水 刷漆 Fe2O3 + 6HCl
,从而阻止铝进一步被氧化(3)氧气 水 刷漆 Fe2O3 + 6HCl  2FeCl3 + 3H2O (4)FeCl2
2FeCl3 + 3H2O (4)FeCl2
18.(1)352g (2)80%
 19.(1) ①②⑦⑧ 石灰石和稀盐酸 CaCO3 + 2HCl
19.(1) ①②⑦⑧ 石灰石和稀盐酸 CaCO3 + 2HCl 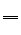 CaCl2 + H2O + CO2↑(2) 试管 ①③④⑤⑥ 2KClO3 2KCl + O2↑(3) 气体的密度 溶解性或能否与水反应
CaCl2 + H2O + CO2↑(2) 试管 ①③④⑤⑥ 2KClO3 2KCl + O2↑(3) 气体的密度 溶解性或能否与水反应
20.Na2CO3 + Ca(OH)2 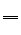 NaOH + CaCO3↓ 可能有碳酸钠
NaOH + CaCO3↓ 可能有碳酸钠
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,滴入足量稀盐酸 | 有气体产生 | 猜想成立 |
【反思与提高】:(1)碳酸钠溶液显碱性能使酚 酞试液变红色;(2)能与酸反应生成二氧化碳气体.
酞试液变红色;(2)能与酸反应生成二氧化碳气体.


