(单词翻译:单击)
一、单项选择(每题2分)
1、今年世界环境日主题为“绿色消费,你行动了吗?”下列行为不符合这一标准的是
A、推广使用节能灯 B、关闭待机电器电源
C、少用一次性筷子 D、尽量使用塑料包装袋
答案:D
【解析】绿色消费,保护环境是主题,具体做法是节约能源,减少污染,减少树木砍伐。
2、下列变化中属于物理变化的是
A、水分蒸发 B、菜刀生锈 C、食品变质 D、蜡烛燃烧
答案:A
【解析】水分蒸发是由液态变气态,分子结构分发生变化,属物理变化。其它均有新物质生成,属化学变化。
3、对制碱工业做出重大贡献的科学家是

答案:B
【解析】制碱工业做出重大贡献的是侯德榜。徐光宪为我国“稀土之父”。张青莲主持测定了铟、铱、锑、铕、铈、锗、锌、镝几种元素的相对原子质量新值,被国际原子量委员会采用为国际新标准。戴安邦是我国配位化学奠基人之一。
4、下列有关生活的化学知识,不正确的是
A、纯水不含有任何化学物质 B、大量使用化 肥造成水体污染
肥造成水体污染
C、熟石灰可改良酸性土壤 D、灼烧闻气味区分蚕丝和棉纱
答案:A
【解析】纯水是由水分子构成的,含有化学物质。大量使用化肥会使过量的有机磷等溶于水中流入河流,造成赤潮、水华等现象,污染水体。熟石灰可以中和酸性土壤的酸性。蚕丝主要成分是蛋白质,含有N、S等元素,灼烧会放出难闻气味,棉花主要元素是C和H,灼烧无特殊气味。
5、下列实验现象的描述正确的是
A、木炭在空气中燃烧产生蓝紫色火焰
B、稀硫酸中滴加石蕊试液,溶液变红
C、镁条在氧气中燃烧,生成黑色固体
D、氢氧化钠中滴加硫酸 铜,产生白色沉淀
铜,产生白色沉淀
答案:B
【解析】木炭空气中燃烧火焰为红色。硫酸显酸性,滴加石蕊会显红色。镁条在氧气中燃烧产生白色固体主要成分是氧化镁,另外含有少量氮化镁。氢氧化钠滴加硫酸铜产生氢氧化铜蓝色沉淀。
6、下列物质的用途不合理的是
A、盐酸除铁锈 B、尿素作钾肥 C、食醋除水垢 D、碱水除油污
答案:B
【解析】盐酸可以与氧化铁反应出去铁表面的铁锈。尿素由C、H、O、N四种元素组成,不含有K,不可做钾肥。食醋可与水垢中的碳酸钙反应,可以除水垢。碱在一定温度下对油污有很好的乳化作用,可以除油污。
7、下列属于人体必需微量元素的是
A、H B、O C、N D、Mn
答案:D
【解析】H、O、N均为人体必需常量元素。
8、下列有关实验操作中不正确的是

答案:D
【解析】氧气验满,应将带火星的火柴放到集气瓶口,若火柴复燃,说明氧气已集满。火柴不能伸入到集气瓶内。而且深入到氧气集气瓶中,出现的现象是剧烈燃烧,不会熄灭。
9、制备多晶硅时,有如下反应:Si+3HCl==X+H2 ↑,X的化学式为
A、SiCl B、SiH2Cl2 C、SiHCl3 D、SiH4
答案:C
【解析】根据质量守恒定律知,化学反应方程式左右两边质量相等,各元素数量相同。X中含有1个Si,1个H和3个Cl。
10、下列食品中富含维生素C的是
A 、猪肉 B、鲫鱼 C、鸡蛋 D、番茄
、猪肉 B、鲫鱼 C、鸡蛋 D、番茄
答案:D
【解析】蔬菜中富含维生素C。猪肉中富含油脂和蛋白质,鲫鱼、鸡蛋均富含蛋白质。
11、下列物质鉴别方法可行的是
A、肥皂水鉴别硬水与软水 B、酚酞试液鉴别硫酸钠溶液与硫酸
C、燃着的木条鉴别N2与CO2 D、品尝的方法鉴别工业盐与食用盐
答案:A
【解析】肥皂水可以鉴别软水和硬水。酚酞溶液在中性和酸性条件下先无色。氮气和二氧化碳均不燃烧也不支持燃烧。工业盐中含有亚硝酸钠,对人体有害,同时鉴别药品不能品尝。
12、某同学用量筒量取5.0ml水时仰视读数,则所量水的体积
A、等于5.0ml B、大于5.0ml C、小于5.0ml D、不能确定
答案:B
【解析】仰视读数,当称量的液体刻度到达5.0ml时,实际体积已经超过5.0ml。
13、下列物质能和盐酸发生中和反应的是
A、硝酸银 B、氧化铜 C、熟石灰 D、锌
答案:C
【解析】和酸中和的一定是碱,硝酸银是盐,氧化铜是碱性氧化物,锌是金属。

二、不定项选择(1~2个正确答案,每题2分)
16、食品安全关系到人体健康,下列说法正确的是
A、霉变的米中含有黄曲霉素不能食用
B、应在国家标准规定的范围内使用食品添加剂
C、用甲醛浸泡水产品,延长保质期
D、将地沟油回收作为食用油
答案:AB
【解析】甲醛浸泡的食物不能食用,地沟油不能作为食用油。
A、某化学反应的微观示意图为: ,关于该反应的说法正确的是
,关于该反应的说法正确的是
A、涉及到五种物质 B、原子的种类不变
C、属于复分解反应 D、分子的种类不变
答案:B
【解析】此反应为化合反应,涉及3种物质,反应前后分子种类发生了变化。
18、右图是NaCl、MgSO4、KCl固 体的溶解度曲线,下列说法正确的是
体的溶解度曲线,下列说法正确的是
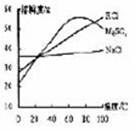
A、60℃三种物质的饱和溶液中,溶质质量分数最大的是KCl溶液
B、将80℃不饱和的MgSO4溶液降温至40℃,一定能得到其饱和溶液
C、40℃时MgSO4的溶解度比NaCl小
D、将80℃含有少量NaCl的KCl饱和溶液降温至20℃,可得到KCl晶体
答案:D
【解析】60℃时,硫酸镁饱和溶液的质量分数最大,80℃不饱和硫酸镁降到40℃时也未必饱和。40℃时,硫酸镁的溶解度比氯化钠大。
19、下列除杂所选试剂合理的是
选项 | 物质 | 杂质 | 试剂 |
A | O2 | H2O | 浓硫酸 |
B | CaO | CaCO3 | H2O |
C | NaCl | Na2CO3 | 盐酸 |
D | Cu | CuO | O2 |
答案:AC
【解析】氧化钙溶于水后变成氢氧化钙,使氧化钙变质。铜中含有氧化铜,通氧气加热后会导致铜氧化成氧化铜。不能出去杂质,反而使杂质增多。
20、Fe2O3、CuO的混合粉末3.20g,,高温下与足量H2充分反应后,得到固体的质量可能为
A、2.24g B、2.40g C、2.56g D4.00g
答案:B
【解析】假设粉末全是氧化铜,反应为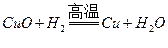 ,3.2g氧化铜能生成2.56g铜。假设全是氧化铁,反应为
,3.2g氧化铜能生成2.56g铜。假设全是氧化铁,反应为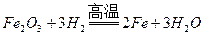 ,3.2g氧化铁能生成2.24g铁。因为是混合粉末,所以还原后生成的固体质量在2.24g-2.56g之间。
,3.2g氧化铁能生成2.24g铁。因为是混合粉末,所以还原后生成的固体质量在2.24g-2.56g之间。
三、(3小题,共27分)
21、(1)写出下列离子的化学符号
铝原子 ,硫酸分子  ;氯离子 ;钠离子 。
;氯离子 ;钠离子 。
(2)请用下列字母顺序填空: a、CuSO4 b、N2 c、NH4H2PO4 d、Cu
用作食品保护气 ,用作导线 ,用作复合肥料 ,用作配波尔多液 。
答案:(1)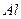 ,
,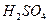 ,
,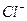 ,
,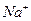 (2)b,d,c,a
(2)b,d,c,a
【解析】氮气分子不活泼,可以做食品保护气。铜可用作导线,复合肥料要有N、P、K中的两种,波尔多液是硫酸铜与熟石灰的混合液。
22、12年5月18日,扬州泰州机场正式首行
(1)航站楼的屋顶用到了以下材料:a、钢板 b、玻璃 c、铝板 d、塑料。其中属于合成材料的是 (填字母,下同),属于无机非金属材料的是 。
(2)下列做法能体现“低碳、环保”理念的是 (填字母)
a、屋顶采用镂空设计,提高采光率
b、机场显示屏采用LED节能材料
c、屋顶防水材料选用光反射率大的新型塑料代替沥青油毡
(3)LED中选用了含P元素的物质作发光材料,写出P元素的名称
(4)航站楼使用了钢架结构
①钢属于 (填“混合物”或“纯净物”)
②铁锈蚀是铁与空气中的 和 (填化学式)等物质作用的结果,防止钢铁锈蚀可以采用的方法有 (任写一种),回收废旧钢铁的目的是 (填字母) a、节约钢铁资源 b、防止钢铁生锈
答案:(1)d,b(2)abc(3)磷(4)①混合物②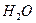 ,
,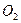 (不分前后),在钢铁表面喷涂油漆或刷防锈油等,a
(不分前后),在钢铁表面喷涂油漆或刷防锈油等,a
【解析】低碳环保理念题中a屋顶镂空设计提高采光率,可以减少用电。LED等同样节能,利用反射率大的新型塑料代替沥青油毡,可以减少屋顶吸热,从而减少开空调时间,节约电能。
23、人类社会需要充足 的能源、良好的环境
的能源、良好的环境
(1)我国南海蕴藏着丰富的“可燃冰”资源,“可燃冰”的成分是甲烷水合物(CH4·xH2O)
①下列有关CH4·xH2O的说法正确的是 (填字母)
a、属于氧化物 b、在低温高压下呈固态
c、碳元素质量分数高于甲烷 d、C、H、O原子个数比为2:6:1
②研究测得某可燃冰样品中,碳的质量分数为7.5%,则x的值为 。
③可燃冰属于 (填“可”或者“不可”)再生资源。
(填“可”或者“不可”)再生资源。
(2)PM2.5表示每立方米空气中直径≤2.5μm的颗粒物含量。我国新修订发布的《环境空气质量标准》规定,居住区、混合区24小时内的PM2.5平均浓度在75µg/m³之内为达标。图为扬州一周PM2.5的实时监测数据
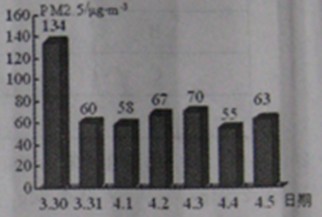
①从图中可知,这周PM2.5超标 天。
②下列措施中不 能降低空气中PM2.
能降低空气中PM2. 5的是 (填字母)
5的是 (填字母)
a、戴口罩 b、禁止焚烧秸秆 c、植树造林
(3)酸雨也是环境问题之一。
①酸雨的PH值 5.6(填>、<或者=)
②形成酸雨的主要物质:含硫煤燃烧产生的 气体(填化学式)、汽车尾气排放产生的氮氧化物(NOx)。汽油中的主要成分是碳氢化合物,你推测汽车尾气中氮元素的来源是 。
③大量使用化石燃料除了会导致酸雨、PM2.5超标以外,还会引起的环境问题有
(任写一种,下同)。因此人们开发了新能源,如 。
答案:(1)①b,②8,③不可。(2)①1,②a(3)①<,②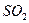 ,空气中的氮气,③气候变暖(温室效应、光化学烟雾、臭氧空洞等),太阳能(或地热能、风能、潮汐能)
,空气中的氮气,③气候变暖(温室效应、光化学烟雾、臭氧空洞等),太阳能(或地热能、风能、潮汐能)
【解析】此题涉及能源与环境问题,可燃冰碳元素的质量分数为7.5%,得可燃冰的分子质量为160,其中结晶水的相对质量为144,所以x=8。在汽车气缸内,部分氧气和氮气在高温条件下反应,主要生成物是NO。
四、(10分)
24、某化工厂为综合利用FeSO4,设计了以下工艺流程:
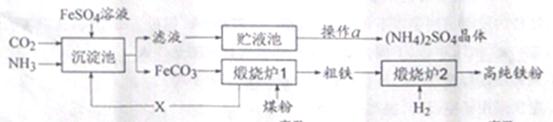
煅烧炉1中发生的部分化学反应有:
(1)煤粉、H2既是重要的化工原料又是重要的能源,氢氧燃料电池可以将 能转化为电能,煤燃烧主要讲化学能转化为 能。
(2)煅烧炉1中还会发生FeO和CO反应,其方程式为  , X
, X 气体的化学式是 ;循环利用X的优点是 。
气体的化学式是 ;循环利用X的优点是 。
(3)下列金属能从FeSO4溶液中置换出Fe的是 (填字母)
a、Al b、Cu c、Ag
(4)实验室模拟操作a 的过程是蒸发浓缩、 、过滤干燥。
(5)请设计实验证明(NH4)SO4是铵态氮肥
实验步骤 | 实验现象 |
|
样品为铵态氮肥 |
答案:(1)化学,热。(2)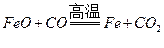 ,
,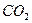 ,减少温室气体排放(或降低生产成本)(3)a(4)降温结晶(5)实验步骤:把一定量(NH4)SO4溶解与试管中,滴入NaOH溶液后,加热溶液,然后将产生的气体通入酚酞试液。现象:酚酞试液变红。或者实验步骤:取少量(NH4)SO4样品放入坩埚中,加入消石灰与其混合后,用研杵研磨。现象:闻到刺激性气味。
,减少温室气体排放(或降低生产成本)(3)a(4)降温结晶(5)实验步骤:把一定量(NH4)SO4溶解与试管中,滴入NaOH溶液后,加热溶液,然后将产生的气体通入酚酞试液。现象:酚酞试液变红。或者实验步骤:取少量(NH4)SO4样品放入坩埚中,加入消石灰与其混合后,用研杵研磨。现象:闻到刺激性气味。
【解析】第(4)问当中,先蒸发浓缩,不能蒸发结晶,因为(NH4)SO4热稳定性差,温度过高会分解。所以待浓度增高后,需要通过降温结晶得到(NH4)SO4晶体,然后再从液体中过滤出来,常温或者低温条件下干燥。第(5)问设计实验,主要考察氨气的性质。
五、(23分)
25、化学兴趣小组利用下图所示装置,测定某碳酸饮料中CO2的含量。
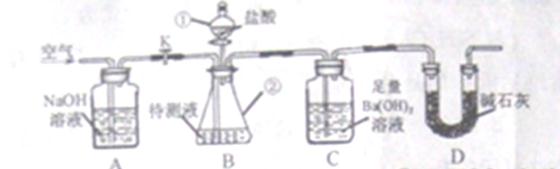
资料:①CO2与足量Ba(OH)2反应生成BaCO3沉淀。②NaHCO3与盐酸反应生成CO2
将一瓶饮料冷藏24小时(未结冰),开封后取一定量样品加入到盛有过量NaOH溶液的容器中,充分反应后作待测液。
回答下列问题:
(1)装置B中仪器①②的名称分别为 和 。加入足量盐酸,仪器②中发生的化学反应方程式为  、
、 。
。
(2)反应后持续缓缓通入空气,若缺少装置A,则实验结果 (填“偏大”、“偏小”或“无影响”,下同),若饮料未冷藏,则实验结果 。
(3)装置D的作用是 ,若冷藏温度过低,饮料结冰,则实验结果明显偏小,可能的原因是 。若不测定C中BaCO3的质量,只测定C在实验前后的质量差,则实验结果明显偏高,原因是  。
。
(4)下列各项措施中,不能提高实验结果准确度的是 。(填字母)
a、滴加盐酸不宜过快
b、在A~B之间添加盛有浓硫酸的洗气装置
c、在B~C之间添加盛有NaHCO3的洗气装置
答案:(1)分液漏斗,锥形瓶。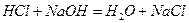 ,
,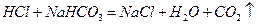 (2)偏大,偏小(3)防止空气当中的二氧化碳进入C装置。饮料结冰后,因为溶剂量减小导致二氧化碳在液体中溶解总量变小。有HCl气体和水蒸气进入C装置中。(4)b c
(2)偏大,偏小(3)防止空气当中的二氧化碳进入C装置。饮料结冰后,因为溶剂量减小导致二氧化碳在液体中溶解总量变小。有HCl气体和水蒸气进入C装置中。(4)b c
【解析】气体在液体中的溶解度是温度越高溶解度越低,温度越低溶解度越大。但是当溶剂比如水结冰后,作为溶剂的水的量减少,导致二氧化碳在水中的溶解量降低。在AB之间加浓硫酸洗气装置可以防止A装置及空气中的水蒸气进入装置C,所以对于提高实验结果准确度有一定作用。在BC之间加盛有NaHCO3的洗气装置,可以吸收氯化氢气体,只有二氧化碳气体进入C装置,对于提高精度有一定作用。
26、碘酸钾(KIO3)主要用作食盐加碘剂
Ⅰ、制备碘酸钾
实验室制备碘酸钾的路线如下:
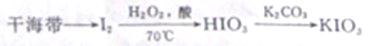
(1)KIO3中I的化合价为 ,含碘盐中的碘是指 (填字母)。
a、离子 b、元素 c、分子
(2)实验中需要用试纸测定溶液的PH,其操作方法是 。
(3)过滤操作需要的玻璃仪器有玻璃棒、烧杯和 。
(4)用冰水洗涤过滤所得KIO3晶体,其原因是 。
(5)温度过高,会造成H2O2利用率降低,可能的原因是 。
Ⅱ测定碘含量
资料:
①碘酸钾与碘化钾反应方程式为:KIO3+5KI+3H2SO4===3K2SO4+3H2O+3I2
②淀粉溶液遇碘显色时,碘浓度越大颜色越深;
③扬州作为轻度缺碘地区,食盐中碘含量(以I计)应为18~33mg/Kg
步骤1:配置以下各种试剂:100g/L食盐溶液,2.14*10-3g/L KIO3溶液,测试液(含10g/L淀粉、196g/L H2SO4、1.66g/L KI)。
步骤2:取5支相同规格小试管,贴上编号标签,按下表要求分别依次加入步骤1中配置的KIO3溶液,测试液、蒸馏水,塞上橡皮塞,混合后有序放置在试管架上(各试管中KIO3完全反应)。
试管编号 | 1 | 2 | 3 | 4 | 5 |
KIO3溶液滴数 | 30 | 25 | 20 | 15 | 10 |
测试液滴数 | 10 | 10 | 10 | 10 | 10 |
蒸馏水滴数 | 0 | 5 | 10 | 15 | 20 |
步骤3:另取一支小试管,一次加入步骤1中所配置的食盐溶液10滴、测试液10滴、和蒸馏水20滴,混合后与步骤2中各试管内颜色对照。
(6)步骤3所得溶液呈 色,则说明该食盐是含碘盐。
(7)步骤2实验的目的是 ,步骤2中测试液的滴数保持一致的原因是 。
(8)若步骤3所得溶液颜色与3号试管一致,则100ml该食盐溶液中含有碘酸钾 mg。该食盐中碘含量为 mg/Kg, 扬州地区要求(填“符合”或“不符合”)。
答案:I、(1)+5,b(2)用洁净的玻璃棒蘸取少量溶液,抹在试纸上,待试纸变色后与比色卡对照读取对应PH值(3)漏斗(4)KIO3在冰水中的溶解度很小,既可以除去晶体表面杂质,又可减少KIO3洗涤是的损失。(5)双氧水热稳定性差,温度较高时会分解产生水和氧气。
II、(6)蓝(7)得到不同浓度KIO3溶液的显色标准;控制测试液变量,保证加入各试管中的测试液的量相同(8)0.428,
【解析】由反应方程式知,碘酸钾与碘化钾的反应分子个数比是1:5,碘酸钾的分子量为214,碘化钾分子量为166,碘的分子量为254。知碘酸钾与碘化钾的质量之比为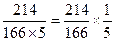 。碘酸钾溶液的浓度为2.14×10-3g/L,碘化钾的浓度为1.66g/L,根据步骤2中1号试管的滴加量来看,知30滴碘酸钾质量量为2.14×10-3g/L×30,10滴测试液中碘化钾的质量为1.66g/L×10,质量之比是
。碘酸钾溶液的浓度为2.14×10-3g/L,碘化钾的浓度为1.66g/L,根据步骤2中1号试管的滴加量来看,知30滴碘酸钾质量量为2.14×10-3g/L×30,10滴测试液中碘化钾的质量为1.66g/L×10,质量之比是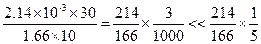 ,所以在实验中碘化钾是过量的,碘酸钾充分反应。
,所以在实验中碘化钾是过量的,碘酸钾充分反应。
步骤3所测溶液颜色与步骤2中3号试管颜色一致,说明两个实验产生的碘的浓度是相同的,因为都是40滴溶液的体积,所以浓度时相同的。

① ②联立,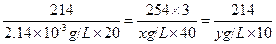
得,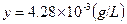
所以100ml食盐溶液中含碘酸钾的量为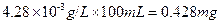 。
。
因食盐溶液浓度为100g/L,所以食盐溶液中碘的含量为,
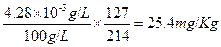 ,18mg/Kg<25.4mg/Kg<33mg/Kg,符合扬州标准。
,18mg/Kg<25.4mg/Kg<33mg/Kg,符合扬州标准。


