(单词翻译:单击)
一、选择题(本题包括12个小题,每小题3分,共36分.每小题只有一个选项符合题意)

3.食品包装袋的制造材料聚乙烯属于下列物质中的( )
A. | 天然纤维 | B. | 塑料 | C. | 合成纤维 | D. | 合成橡胶 |
【答案】B
【解析】 合成材料是有机合成高分子材料的简称,通常包括塑料、合成纤维和合成橡胶三类,而聚乙烯是塑料材料的一种,可分析选项中物质的成分及类别便可解答。天然纤维是天然存在的纤维,而聚乙烯则由人工合成;塑料的种类较多一般为有机高分子合成材料,聚乙烯是其中的一种,故正确;合成纤维是有机高分子材料的一种,但聚乙烯不属于合成纤维;合成橡胶是有机高分子材料的一种,但聚乙烯不属于合成橡胶。
【点评】 本题主要考查材料的分类方法,要从材料的分类方法方面进行分析、判断,从而得出正确的结论。
4.成都市正在推行垃圾分类回收,垃圾收集点通常放置“可回收垃圾”与“其他垃圾”两种垃圾桶.以下生活垃圾应放在其他垃圾桶内的是( )
A. | 废报纸 | B. | 塑料瓶 | C. | 果皮 | D. | 易拉罐 |
【答案】C
【解析】废报纸可回收;塑料瓶可回收;果皮不需要回收;易拉罐可回收。
【点评】 本题考查哪些物质可以回收,哪些物质不可以回收,为了增强人们的环保意识,变废为宝,别把垃圾放错了位置。
5.如图是元素周期表中某元素的相关信息,从图中不能获得的信息是( )
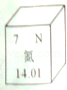
A. | 该元素是非金属元素 | B. | 该元素的原子序数为7 | |
C. | 该元素的相对原子质量是14.01 | D. | 氮气的化学式为N2 |
【答案】D
【解析】 根据图中元素周期表可以获得的信息:原子序数、相对原子质量、元素符号、元素种类等,进行分析判断即可。根据元素周期表中的一格中获取的信息,该元素的名称是氮,为非金属元素;该元素的原子序数为7;可知元素的相对原子质量为14.01;无法获得氮气化学式的信息。
【点评】 本题难度不大,考查学生灵活运用元素周期表中元素的信息及辨别元素种类的方法进行分析解题的能力。
6.某化学反应过程的微观示意图如图,下列说法错误的是( )
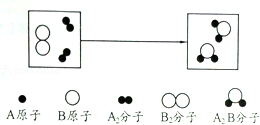
A. | 原子是化学变化中的最小粒子 | |
B. | 元素的种类、原子的数目在化学反应前后 不变 | |
C. | 在化学变化中分子分成原子,原子又重新组合成新物质的分子 | |
D. | 上述反应的化学方程式表示为:2A+B=A2B |

8.下列物质不能用于鉴别氢氧化钠溶液和稀盐酸的是( )
A. | 紫色石蕊溶液 | B. | 氯化钠溶液 | C. | 铁粉 | D. | pH试纸 |
【答案】B
【解析】 一剂鉴别(即限用一种试剂来鉴别多种物质),其原理是选择一种试剂,分别加入到待测物质中,会出现明显不同的现象;然后据此将其逐一鉴别开来,可以据此来解答该题。紫色石蕊遇稀盐酸变红,遇氢氧化钠溶液变蓝,故A可以区分出氢氧化钠溶液和稀盐酸;氯化钠和稀盐酸都不能反应,故B不能用于鉴别氢氧化钠溶液和稀盐酸;铁粉可以和稀盐酸反应,而氢氧化钠溶液不能和铁粉反应,故C能用于鉴别氢氧化钠溶液和稀盐酸;稀盐酸呈酸性,而氢氧化钠呈碱性,所以可以用pH试纸来鉴别,故D能用于鉴别氢氧化钠溶液和稀盐酸。
【点评】 区别物质时利用性质差异,选取现象明显的变化进行区别,有些反应无明显的实验现象,不适合用来区别物质,这是鉴别题的一般规律。
9.下列有关金属的说法错误的是( )
A. | 常温下金属均为固态 | |
B. | 合金的很多性能与组成它们的纯金属不同 | |
C. | 铁在潮湿的空气中比在干燥的空气中更易生锈 | |
D. | 铝在空气中表面会生成致密的氧化铝薄膜,使铝具有很好的抗腐蚀性能 |
【答案】A
【解析】 金属具有金属光泽,常温下大部分金属都是固体,但常温下汞是液体;合金是具有金属特性的物质;性能与组成它的金属的性能有差别;铁生锈的条件是铁同时与水和空气接触,所以铁在潮湿的空气中比在干燥的空气中更易生锈;铝具有自我保护作用,铝表面易形成致密的氧化膜可阻止铝进一步被氧化。
【点评】 解答本题要掌握各种物质的性质方面的知识,只有这样才能对相关方面的问题做出正确的判断。
10.为比较A、B、C三种金属的活动性,某同学设计了如图所示实验,由此判断三种金属活动性由强到弱的顺序是( )
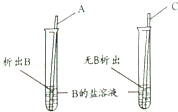
A. | A>C>B | B. | A>B>C | C. | C>A>B | D. | B>C>A |
【答案】B
【解析】 根据金属活动性顺序表的应用:排在金属活动性顺序中前面的金属一般能把排在后面的金属从其盐溶液里置换出来分析解答。由图示可知:A能把B从其盐溶液中置换出来,说明A的活动性比B强;C不能把B从其盐溶液中置换出来,说明C的活动性比B弱,所以三者的金属活动性由强到弱的顺序是A>B>C。
【点评】 了解金属活动性顺序表的应用,并会用来分析和解决问题是解题的关键。
11.下列生活中常见现象用微观粒子解释不正确的是( )
现象 | 解释 | |
A | 温度计中的水银球受热体积膨胀 | 汞原子受热体积变大 |
B | 25m3的石油气在加压情况下可装入容积为0.024m3的钢瓶中 | 气体分子间间隔大,易于压缩 |
C | 一小匙蔗糖放入20mL水中很快就“消失” | 分子在不断运动 |
D | 晴天晾晒衣服比阴天更易干燥 | 温度升高,分子运动速率加快 |
【解析】A
【答案】 根据分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种物质的分子性质相同,不同物质的分子性质不同,结合事实进行分析判断即可。水银是金属汞的俗称,是由原子直接构成的,温度计中的水银球受热体积膨胀是利用了汞原子的间隔(而不是体积)受热变大;分子间有间隔,气体受压后,分子间隔变小,气体的体积减小.石油气分子之间有一定的间隔,在加压时分子之间的间隔变小,故25m3的石油气在加压情况下可装入容积为0.024m3的钢瓶中;一小匙蔗糖放入20mL水中很快就“消失”,是由于分子是在不断运动的,蔗糖的分子运动到水分子中间去了;晴天晾晒衣服比阴天更易干燥,是由于温度升高,分子运动速率加快,故选项解释正确。
【点评】 本题难度不大,掌握分子的基本性质及利用分子的基本性质分析和解决问题的方法是解答此类题的关键。
12.固体物质A、B的溶解度曲线如图所示,下列说法错误的是( )
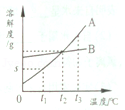
A. | B物质的溶解度受温度影响变化较小 | |
B. | t1℃,A物质的溶解度为sg | |
C. | t2℃,A、B两种物质的溶解度相等 | |
D. | t3℃,A、B两种物质的溶液,A的溶质质量分数一定大于B的溶质质量分数 |
【答案】D
【解析】 由溶解度曲线可以看出物质的溶解度随温度的变化情况;据已知的温度可以查出有关物质的溶解度;可以判断或比较相同温度下,不同物质溶解度的大小(或饱和溶液中溶质的质量分数的大小)。由溶解度曲线可以看出B物质的溶解度随温度的变化较小;由溶解度曲线可知:t1℃,A物质的溶解度为sg;由溶解度曲线可知:t2℃,AB两物质的溶解度交于一点,说明该温度下,两物质的溶解度相等;t3℃,A物质的溶解度大于B物质的溶解度,说明该温度下两物质的饱和溶液中,A的溶质质量分数一定大于B的溶质质量分数;若不饱和,无法比较。
【点评】 解题时可以根据溶解度曲线的应用分析解答,同时明确溶液饱和时质量分数的计算式为 ×100%.
×100%.
二、(本题包括2个小题,共12分)
13.当前我市部分中小学推行“阳光食堂”工程.下表为某校食堂某天午餐部分食谱.
主食 | 荤菜 | 素菜 |
米饭 | 红烧牛肉 | 炒胡萝卜、炒黄瓜 |
(1)食谱中富含蛋白质的是 红烧牛肉 ,富含蛋白质的是 (填上表中的一种主食或 菜名),米饭中主要含有人体必需的营养素是 。
菜名),米饭中主要含有人体必需的营养素是 。
(2)食堂使用铁强化酱油,酱油中加铁强化剂是为了防止 缺铁性贫血病 。
(3)食堂严禁使用霉变食材,霉变的大米 。
A.可以食用 B. 蒸煮后可以食用 C. 绝对不能食用
同学给学校食堂的下列建议不合理的是 。
A.在主食中补充粗粮 B. 多提供油炸食物 C. 适当提供水果
【答案】(1)红烧牛肉 炒胡萝卜、炒黄瓜 糖类 (2)缺铁性贫血病(3)C(4)B
【解析】(1)肉类中富含蛋白质;青菜中含维生素;米饭中含糖类;(2)酱油中加铁强化剂是为了防止缺铁性贫血;(3)霉变的大米不可食用;霉变的大米蒸煮后也不可食用;霉变的大米绝对不能食用。
(4)在主食中补充粗粮有利于身体健康,故建议合理;多提供油炸食物,不利于身体健康,故建议不合理;适当提供水果,有利于身体健康,故建议合理。
【点评】 “吃得营养,吃出健康”是人类普遍的饮食追求,人们把对健康饮食的追求提上了生活的日程,所以对六大营养素的考查也成了热点之一,特别是六大营养素包括的种类、生理功能、食物来源、缺乏症,摄入时的注意事项等内容。
14.自来水是我国目前主要的生活饮用水,下表是我国颁布的生活饮用水水质标准的部分内容.
项目 | 标准 |
感官指标 | 无异味、异臭等 |
化学指标 | pH6.5﹣8.5,铜<1.0mg•L﹣1,氟化物<1.01.0mg•L﹣1,游离氯≥0.3mg•L﹣1等 |
(1)感官指标表现的是自来水的 性质(填“物理”或“化学”);若化学指标中的pH =8时,表明自来水呈 (填“酸性”、 “碱性”或“中性”)。
(2)自来水属于 (填“纯净物”或“混合物”); 自来水中的游离氯有少量可转变成氯离子,氯离子的符号是 。
(3)实验室用自来水制取蒸馏水的方法是 。
A.吸附 B.沉淀 C.过滤 D.蒸馏
(4)长期饮用蒸馏水 (填“利于”或“不利于”)人体健康。
【答案】(1)物理 碱性(2)混合物 Cl-(3)D(4)不利于
【解析】(1)物理性质是指不需要经过化学变化就表现出来的性质,化学性质是指在化学变化中表现出来的性质;pH>7,溶液显碱性;(2)自来水中含有多种可溶性和不溶性杂质,属于混合物;根据离子符号的书写方法写出氯离子的符号;(3)实验室用自来水制取蒸馏水的方法是蒸馏;(4)蒸馏水不含人体所必需的一些微量元素,故长期饮用对人体不利。
【点评】 本题考查了学生对水的净化、物质的性质等知识的掌握和应用,难度不大,掌握相关知识即可顺利解答。
三、(本题只有1个小题,共10分)
15.实验室用一氧化碳还原氧化铜制取铜.
(1)若用8g氧化铜与足量一氧化碳反应,能制得铜的质量为多少?
(2)若一氧化碳量不足,制得的铜中会含有少量未被还原的氧化铜.要除去其中的氧化铜,可向反应后所得固体混合物中加入足量 溶液,充分反应后, (填操作名称).反应的化学方程式是 。
【答案】(1)6.4g (2)稀硫酸 过滤 CuO+H2SO4═CuSO4+H2O
【解析】 (1)根据8g氧化铜通过方程式计算出铜的质量即可;(2)根据铜与酸不反应,氧化铜与酸反应考虑本题,再结合方程式的写法考虑.
解:(1)设8g氧化铜与足量一氧化碳反应,能制得铜的质量为X则:
CO+CuO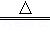 Cu+CO2
Cu+CO2
80 64
8g X
根据: 解得X=6.4g;
解得X=6.4g;
(2)铜与酸不反应,氧化铜与酸反应,所以加入稀硫酸将氧化铜反应掉,再进行过滤,就能得到铜了;反应物是氧化铜和硫酸,生成物是硫酸铜和水,用观察法配平即可。
故答案为:(1 )6.4g;(2)稀硫酸;过滤;CuO+H2SO4═CuSO4+H2O。
【点评】 除杂质原则:加入的试剂只能与杂质反应,不能与需要的物质反应,不能引入新的杂质。
四、(本题包括2个小题,共18分)
16.实验室制取氧气,可供选择的实验装置如图所示.
(1)若用氯酸钾与二氧化锰加热制氧气,可选用A装置,其中的玻璃仪器有 试管(或酒精灯) (填一种).反应的化学方程式是 2KClO3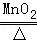 2KCl+3O2↑ ;二氧化锰是反应的 催化剂 .
2KCl+3O2↑ ;二氧化锰是反应的 催化剂 .
(2)若用过氧化氢溶液和二氧化锰来制取氧气,应选择的气体发生装置是 B (填装置序号),在加试剂之前的操作是 检查装置的气密性 .
(3)若收集一瓶氧气,供硫粉在氧气中燃烧的实验使用,最好选择气体收集装置中的 E (填装置序号),理由是 集气瓶底部要留少量水 .
【答案】(1)试管(或酒精灯);2KClO3 2KCl+3O2↑;催化剂(2)B;检查装置的气密性
2KCl+3O2↑;催化剂(2)B;检查装置的气密性
(3)E;集气瓶底部要留少量水
【解析】(1)A装置中的玻璃仪器有酒精灯和试管;氯酸钾与二氧化锰加热制氧气反应的化学方程式是:2KClO3 2KCl+3O2↑;其中的二氧化锰是催化剂。
2KCl+3O2↑;其中的二氧化锰是催化剂。
(2)用过氧化氢溶液和二氧化锰来制取氧气,是固体和液体的不加热反应,可用装置B作发生装置;在加试剂之前一定要对装置进行气密性的检查。
(3)硫燃烧会生成有毒气体二氧化硫,二氧化硫可以被水吸收,所以在集气瓶底部要有少量水,用E排水法收集最合适。
【点评】 本道题主要考查了实验室制取气体发生装置和收集装置的选择,发生装置主要取决于反应物的状态和反应条件,收集装置主要取决于气体的密度、溶水性、是否有毒、是否与水反应、是否与空气中的物质反应等。
17. A、B、C是三种常见的含钙化合物.它们之间有如图所示的转化关系(部分产物略去):
(1)A物质的化学式是 ,B物质的俗称是 ,C物质的名称是 。
(2)向A的块状固体上滴加水,观察到大量的水蒸气产生,该现象说明 。
(3)举出B物质在农业生产中的一种用途: 。
(4)反应②的化学方程式为 ,该反应可以用来检验二氧化碳气体,实验现象是 。
反应③的基本反应类型是 ,该反应前后碳元素的化合价 (填“改变”或“不改变”)。

【答案】(1)CaO 熟石灰(或消石灰) 碳酸钙(2)氧化钙与水反应放出大量的热(3)改良酸性土壤(或者杀菌消毒) (4)Ca(OH)2+CO2=CaCO3↓+H2O 生成白色沉淀(5)复分解反应 不改变
【解析】由于A、B、C均是含钙化合物,所以在初中应该在氧化钙、碳酸钙、氢氧化钙之中.由于C能高温分解,所以C为碳酸钙.A是高温煅烧产物,为氧化钙.而氧化钙和水反应能够得到氢氧化钙(B).氢氧化钙与二氧化碳和碳酸钠反应都能得到碳酸钙.即A:氧化钙;B、氢氧化钙;C、碳酸钙。
(1)A物质为氧化钙,在氧化钙中钙元素为+2价的,而氧元素为﹣2价的,根据在化合物中化合价代数和为零可得其化学式是 CaO;B物质为氢氧化钙,其俗称是 熟石灰(或消石灰);C物质为碳酸钙。
(2)向A(氧化钙)的块状固体上滴加水,观察到大量的水蒸气产生,由于水由液态转化为气态需要吸热,所以该现象说明氧化钙与水反应放出大量的热。
(3)B(氢氧化钙)有碱性,所以可以用来改良酸性土壤,同时本身具有一定的腐蚀性,所以可能用来杀菌消毒。
(4)反应②是氢氧化钙和二氧化碳反应,对应生成物为碳酸钙和水,其化学方程式为 Ca(OH)2+CO2=CaCO3↓+H2O,该反应可以用来检验二氧化碳气体,实验现象是 生成白色沉淀。
(5)反应③是氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,对应的方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,由于是两种化合物相互交换成分,生成新的两种化合物,属于基本反应类型的 复分解反应,该反应前后碳元素的化合价不改变。
【点评】 从限定物质中对号入座,将转化关系用于印证彼此的转化要求即可。
五、(本题只有1个小题,共14分)
18.某品牌纯碱中含有少量氯化钠.某化学探究小组为了测定该纯碱的纯度(即碳酸钠的质量分数),组内一同学设计了如下实验:
【设计实验方案】实验装置(如图2所示,固定装置略去);

需要测定的实验数据:纯碱样品的质量;实验前、后装置(包括氢氧化钠固体)的总质量.
(1)A装置中反应的化学方程式为 Na2CO3+H2SO4═Na2SO4+H2O+CO2↑ ;为了保证纯碱样品中的碳酸钠完全反应,其操作是 逐滴滴入稀硫酸至不再产生气泡为止 .
(2)B装置的作用是 除去水蒸气 ;C装置中反应的化学方程式为 2NaOH+CO2═Na2CO3+H20 .
(3)补充D装置 装氢氧化钠固体的球形管 (简要叙述或画出装置示意图).
【交流与表达】
(4)有同学认为图2所示实验装置会造成测得纯碱的纯度偏低,原因是 AB装置中残留反应产生的二氧化碳气体未被C中的氢氧化钠吸收, .
(5)为了克服图2装置的不足,有同学提出,还应增加图1装置与A装置连接(A装置中原双孔橡胶塞换成三孔橡胶塞),在反应前、后用图1装置分两次缓缓鼓入足量空气.
①反应前,断开B、C装置之间的连接,用图1装置鼓入空气的作用是 用不含二氧化碳的空气排出AB装置中原有的空气 ;
②反应后,用图1装置鼓入空气的作用是 用不含二氧化碳的空气排出残留在AB装置中反应产生的二氧化碳气体 ;
③在A装置中的反应发生时,开关R处于关闭状态,其原因是 避免图1装置吸收反应产生的部分二氧化碳气体 .
【数据处理】
(6)称得的纯碱样品质量为10.8g,实验前、后C装置的总质量分别为75.2g和79.6g,纯碱的纯度为 98.1 %(计算结果保留小数点后一位).
【反思与评价】
(7)能否用稀盐酸代替稀硫酸?同学们经过讨论认为不能,理由是 稀盐酸会发出氯化氢气体,被C装置吸收,影响实验测定 .
(8)改进后的实验装置能减少测定的误差,原因是①反应生成的CO2尽可能被C装置吸收;② 避免AB装置中原来空气中二氧化碳气体对实验的干扰 .
【答案】(1)Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;逐滴滴入稀硫酸至不再产生气泡为止;(2)除去水蒸气;2NaOH+CO2═Na2CO3+H20;(3)装氢氧化钠固体的球形管;(4)AB装置中残留反应产生的二氧化碳气体未被C中的氢氧化钠吸收;(5)①用不含二氧化碳的空气排出AB装置中原有的空气;②用不含二氧化碳的空气排出残留在AB装置中反应产生的二氧化碳气体;③避免图1装置吸收反应产生的部分二氧化碳气体;(6)98.1%;(7)稀盐酸会发出氯化氢气体,被C装置吸收,影响实验测定(8)避免AB装置中原来空气中二氧化碳气体对实验的干扰。
【解析】(1)反应物是Na2CO3和H2SO4生成物是Na2SO4、H2O和CO2用观察法配平,二氧化碳后面标上上升符号;因为该反应有气泡产生,没有气泡产生了,说明反应完了;
(2)浓硫酸具有吸水性,所以主要是除去二氧化碳中的水蒸气;C装置中反应的反应物是NaOH和CO2生成物是Na2CO3和H20,用观察法配平;
(3)D装置是防止空气中的水、二氧化碳进入C装置造成误差,所以用装氢氧化钠固体的球形管就能达到目的;
(4)反应结束后在AB装置中会残留反应生成的二氧化碳气体未被C中的氢氧化钠吸收,导致二氧化碳质量减少,结果会偏小;
(5)①鼓入的空气经过了氢氧化钠,已经把空气中二氧化碳除去,用不含二氧化碳的空气排出AB装置中原有的空气,由于原有的空气中含有二氧化碳;
②用不含二氧化碳的空气排出残留在AB装置中反应产生的二氧化碳气体,使反应产生的二氧化碳全部被C装置吸收;
③如果不处于关闭状态,生成的二氧化碳会进入图1被图1中氢氧化钠吸收;



