(单词翻译:单击)
第Ⅰ卷( 选择题共15分)
选择题(本题包括15小题,每小题只有1个选项符合题意。每小题1分,共15分)
1.下列变化属于化学变化的是
A. 钢铁生锈B.石蜡熔化C.滴水成冰D.瓷碗破碎
2.下列物质属于纯净物的是
A.空气B.酒精C.海水D.石油
3. 人体摄入的碘过多或过少都会引起甲状腺肿大,因此目前市场上有加碘食盐和不加碘食盐供消费
者选择。这里的“碘”是指
A.元素B.分子C.原子D.离子
4. 节能减排对发展经济、保护环境有着重要意义。下列措施不符合“节能减排”理念的是

5. 将少量下列物质分别放到水中,充分搅拌,不能得到溶液的是
A.蔗糖B.氯化钠 C.面粉D.高锰酸钾
6.下列装置或操作肯定不能达到实验目的的是
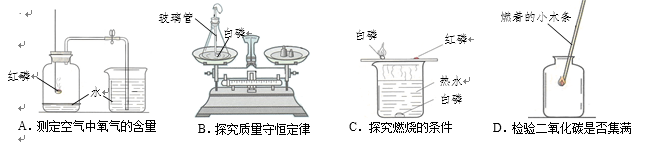
7.从分子和原子的角度分析并解释下列事实,其中不正确 的是
的是
A.品红在水中扩散——分子在不断运动
B.物体的热胀冷缩——分子的大小发生变化
C.氧化汞分解成汞和氧气——分子可以再分
D.一滴水中大约有1.67×1021个水分子——分子很小
8.下列叙述正确的是
A.从外观即可区分磷矿粉和尿素
B.人体呼出的气体中含量最多的是二氧化碳
C.厨房中煤气泄漏时应立即打开抽油烟机排气
D.能用点燃的方法除去二氧化碳中混有的少量一氧化碳
9.下列食物中富含维生素的是

10.下列实验现象的描述不正确的是
A.镁条在空气中燃烧发出耀眼白光
B.硫在氧气中燃烧发出蓝紫色火焰
C.点燃羊毛纤维能闻到烧焦的羽毛味
D.打开浓硫酸的瓶盖瓶口出现大量白烟
11.葡萄糖(化学式是C6H12O6)能为人体组织提供营养。下列叙述正确的是
A.葡萄糖属于有机化合物 B.葡萄糖的相对分子质量为180g
C.葡萄糖中含有6个氧原子 D.葡萄糖中C、H、O三种元素的质量比为6∶12∶6
12.右图是甲、乙两种物质的溶解度曲线,下列叙述正确的是

A.20℃时,甲的溶解度大于乙的溶解度
B.40℃时,甲、乙两种物质的溶解度相等
C.采用降温的方法可以将乙的不饱和溶液转化为饱和溶液
D.60℃时,在100g水中加入100g甲,充分溶解后溶液质量为200g
13.化学使世界变得更加绚丽多彩。下图是物质间发生化学反应的颜色变化,其中无色溶液X是

A.稀盐酸 B.澄清石灰水 C.稀硫酸 D.硫酸钠溶液
14.中考复习阶段,小荷同学梳理了以下知识:①煮沸可以降低井水的硬度;②某粒子的结构示意
图为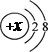 ,该粒子一定是氖原子;③将肥皂水滴到pH试纸上,观察到试纸由黄色变成红色;④自制简易净水器中的活性炭能吸附、过滤水中的杂质;⑤为了增强肥效,应将铵态氮肥和草木灰混合施用;⑥利用铜、铁、AgNO3溶液能探究出铜、铁、银的金属活动性顺序。其中正确的
,该粒子一定是氖原子;③将肥皂水滴到pH试纸上,观察到试纸由黄色变成红色;④自制简易净水器中的活性炭能吸附、过滤水中的杂质;⑤为了增强肥效,应将铵态氮肥和草木灰混合施用;⑥利用铜、铁、AgNO3溶液能探究出铜、铁、银的金属活动性顺序。其中正确的 是
是
A.①②④⑤⑥B.②③④⑤ C.①④⑤D.①④⑥
15.一定条件下,在一密闭容器中发生某反应,测得反应过程中各物质的质量如下表所示:
物质 | X | Y | Z | Q |
第一次测得的质量/g | 32 | 51 | 漏测 | 6 |
第二次测得的质量/g | 60 | 17 | 11 | 12 |
下列判断正确的是
A.该反应中X和Q的质量变化之比为5∶1
B.该反应的化学方程式可表示为:Y → X+Z+Q
C.Z 可能是该反应的催化剂
可能是该反应的催化剂
D.该反应可能是置换反应
第II卷(非选择题共35分)
16.(8分)化学就在我们身边,它与我们的生活息息相关。
(1)请从“氮气、干冰、不锈钢、汽油”中选择适当的物质填空:
①可用于制造医疗器械的是__________ ;②可用于人工降雨的是 __________ ;
③可用于除去衣服上油污的是__________ ;④可用作保护气的是 __________ 。
(2)现有H、C、O、Ca四种常见的元素,请选用其中的元素写出符合下列要求的物质各一种(用化学式表示):
①常用的溶剂 __________ ;②大理石的主要成分 __________ ;
③天然气的主要成分 __________ ;④汽水中含有的一种酸 __________ 。
17.(5分)写出下列反应的化学方程式,并在括号内注明基本反应类型:
(1)水的电解 __________ ,( __________)反应;
(2)生石灰投入水中 __________ ,( __________)反应;
,( __________)反应;
(3)一氧化碳还原氧化铜 __________ 。
。
18.(7分)通过对化学的学习,你已掌握了实验室制取气体的有关规律,请结合下图回答有关问题:
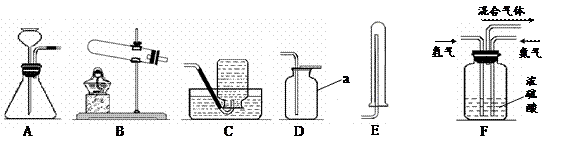
(1)图中标有a的仪器名称是 __________。
(2)实验室用氯酸钾制取氧气,反应的化学方程式为__________ ,可选择的收集装置是D或 __________ (填字母,下同)。
(3)实验室用锌和稀硫酸制取氢气,应选择的发生装置是__________,反应的化学方程式为__________ 。
(4)氨气是一种无色、有刺激性气味、极易溶于水的气体,可用于制氮肥、硝酸、药物和染料等。
①实验室常用加热氯化铵和熟石灰的固体混合物的方法制取氨气,则实验室制取并收集氨气应选择的装置组合是__________。
②工业上用氮气和氢气合成氨气(反应的化学方程式:N2+3H2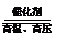 2NH3)。实验室模拟合成氨气的流程如下:
2NH3)。实验室模拟合成氨气的流程如下:

流程中“气体的混合”是在F装置中进行的,F装置的作用有三个:一是将氮气和氢气干燥;二是使氮气和氢气充分混合;三是__________,从而提高氮气和氢气的利用率。
19.(5分)MnO2是一种重要的无机功能材料,粗MnO2(含有较多的MnO和MnCO3)的提纯是工业生产的重要环节。下图是某研究性学习小组在实验室中模拟工业上粗MnO2转化为纯MnO2的工艺流程。

请回答下列问题:
(1)操作A的名称是__________。
(2)NaClO3中氯元素的化合价为__________价。
(3)蒸发所需的仪器有铁架台(带铁圈)、蒸发皿、酒精灯和 __________。
(4)写出加稀H2SO4时产生CO2的化学方程式__________。
(5)该流程中可以循环利用的物质是H2SO4和__________ 。
20.(10分)某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O通电2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”。某研究性学习小组对该厂生产的烧碱样品进行如下探究。
I.定性探究
【提出问题】烧碱样品中可能含有哪些杂质?
【猜想】猜想一:可能含有Na2CO3,作出此猜想的依据是 __________ (用化学方程式表示)。
猜想二:可能含有NaCl,作出此猜想的依据是 __________ (用简洁的文字表述)。
【设计实验】
实验步骤 | 实验现象 | 解释或结论 |
①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁。 | 试管外壁发热 | 原因是 __________ |
②向①所得的溶液中逐滴加入稀硝酸至过量 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体。 |
样品中含有的杂质是__________
|
③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂质是__________ |
【交流与讨论】小明同学提出:“上述实验中稀硝酸也可以用稀盐酸代替”。你认为他的观点
__________ (填“正确”或“不正确”)。
II.定量探究
【提出问题】烧碱样品中氢氧化钠的质量分数是多少呢?
【设计实验】小婉同学设计探究方案后进行实验并测得数据如下:
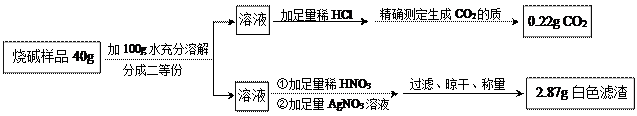
请你利用小婉同学测得的数据计算烧碱样品中氢氧化钠的质量分数(请列出计算过程)。
【交流与反思】小强同学认为小婉同学设计的探究方案不够严密,其理由是:
(1)探究方案中未考虑氢氧化钠的吸水性。
(2)探究方案中因缺少 __________(填操作名称),导致测得的氢氧化钠的质量分数偏小。
第I卷选择题(共15分)
选择题(本题包括15小题,每小题1分,共15分。每小题只有1个选项符合题意)
1.A 2.B 3.A 4.D 5.C 6.D 7.B 8.A 9.C 10.D
11.A12.B13.C14.D15.C
第II卷(非选择题共35分)
16.(8分,每空1分)
(1)①不锈钢②干冰③汽油④氮气
(2)①H2O(或C2H5OH) ②CaCO3 ③CH4④H2CO3
17. (5分,每空1分)
(1)2H2O通电2H2↑+O2 ↑分解
(2) CaO + H2O ==== Ca(OH)2化合
3)CO+CuO====CO2+Cu
18. (7分,每空1分)
(1)集气瓶(2)2KClO3======2KCl+3O2↑C(3)AZn+H2SO4===ZnSO4+H2 ↑
(4)①BE②通过观察F中的气泡控制氮气和氢气的流量,使氮气和氢气的量达到最佳比例
19. (5分,每空1分)
(1)过滤(2)+5(3)玻璃棒(4)MnCO3+H2SO4===MnSO4+H2O+CO2 ↑
(5)NaClO3
20. (10分,除计算外每空1分)
2NaOH+CO2===Na2CO3+H2O
氢氧化钠从电解后的溶液中析出时有少量未反应的氯化钠同时析出
实验步骤 | 实验现象 | 解释或结论 |
氢氧化钠 | ||
碳酸钠(或Na2CO3) | ||
氯化钠(或NaCl) |
不正确
解:设20g样品中含Na2CO3的质量为x,NaCl的质量为y。
Na2CO3+2HCl====2NaCl+H2O+CO2 ↑NaCl+AgNO3====AgCl↓+NaNO3
106 4458.5143.5
x 0.22gy2.87g
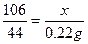
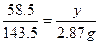
 x=0.53g(1分)y=1.17g (1分)
x=0.53g(1分)y=1.17g (1分)
氢氧化钠的质量分数=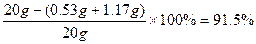 (1分)
(1分)
答:样品中氢氧化钠的质量分数为91.5%
洗涤

 固体溶于水放热
固体溶于水放热
