(单词翻译:单击)
一、单项选择题(本大题包括10个小题,每小题2分,共20分)
1、下列物质属于纯净物的是 ( C )
A.洁净的空气B.透明的汽水C.固态氧D. NaCl溶液
2、物质的下列性质中,属于化学性质的是 ( C )
A.颜色、状态B.密度、硬度C.氧化性、还原性D.熔点、沸点
3、在化学反应中,一定发生变化的是 ( B )
A.原子种类 B.分子种类 C.元素种类 D.物质的状态
4、误食工业用盐亚硝酸钠(NaNO2)会使人中毒,NaNO2,中氮元素的化合价为( B )
A. +2 B. +3 C. +4 D. +5
5、造成酸雨的主要物质是( D )
A. CH4和CO B. CO和SO2, C. CO和CO2 D. NO2和SO2
6、适量食用海带(含丰富的碘元素)可顶防( A )
A.甲状腺肿大B.骨质疏松C.贫血 D.生长迟缓
7、下列化学肥料中,属于复合肥料的是 ( A )
A. NH4H2PO4 B. NH4NO3 C. (NH4)2S04 D. NH4HCO3
8、李飞同学记录的下列实验数据中,不合理的是( A )
A.pH试纸测得某溶液的pH为5.3
B.用1OmL最筒最取7.5mL水
C.测得某粗盐中NaCl的质量分数为92.58%
D.用托盘天平称得食盐16.8g
9、关于过滤操作的下列叙述中,不正确的是( D )
A.滤纸的边缘低于漏斗口 B.液面低于滤纸边缘
C.玻璃棒靠在三层滤纸一边 D.漏斗下端的管口至于烧杯的中间
反应物 | X | Y | Z |
Z(NO3)2 | × | √ | |
稀盐酸 | × | √ | √ |
 10、为了比较X、Y、Z三种金属的金属活动性,小明同学进行了一系列实验并记是在下表。其中“√”为能反应“×”为不能反应,无标记的表示实捡未做。则它们的金属活动性顺序为:
10、为了比较X、Y、Z三种金属的金属活动性,小明同学进行了一系列实验并记是在下表。其中“√”为能反应“×”为不能反应,无标记的表示实捡未做。则它们的金属活动性顺序为:
A.Y>Z>X B.Y>X>Z C.X>y>Z D.X>Z>Y
二、填空题(本大题包括4小题,共14分)
11、(2分) 《三国演义》里描述的赤壁之战中,周瑜的军队借助东风火烧了曹营的木船而大败曹军。根据右图可知,曹营的木船是可燃物,该燃烧还具备了下列两个条件:①木船与氧气(或空气) 接触,② :你给曹军的灭火建议及所依据的原理是: 。

12、(3分〉已知某粒子(原子或离子)的核外有2个电子层,其结构示意图为:
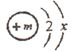
(1)若该粒子为原子时,则m = ;
(2)若该粒子为阴离子时,则m-2 x(“>”、“<”、“=”);
(3)若x=8,请写出符合该组成结构且显不同电性的各一种粒子的化学符号:。
答案:(1)2+x (2)<(3)Na+(或Mg2+等)、O2-(或F-等)
13、(5分)李红同学在复习元素化合物知识时,归纳了如右图所示的物质间关系。图中横线两端的物质在一定条件下都能发生化学反应;X、Y是初中化学中常见的一种单质和一种化合物,且此化合物与图中已知物的类型不同。请你回答:
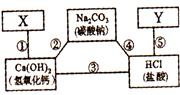
(1)用图中给出的物质写出一个有沉淀生成的化学反应方程式 ;
(2)写出X、Y可能的化学式各一种:X、Y;
(3)若人体胃酸过多时,需要服用含A I(OH)3的”胃舒平"药剂,其利用的反应原理与图示关系中反应③的原理相同,该反应的化学方程式为:;
I(OH)3的”胃舒平"药剂,其利用的反应原理与图示关系中反应③的原理相同,该反应的化学方程式为:;
(4)请写出一个符合下列要求的化学反应方程式: 反应物(可以是图示以外的)是两种化合物,但反应类型不属于四种基本类型中的任何一种:。
14、(4分)如图所示为A、B、C三种物质的溶解度曲线。请回答下列问题:
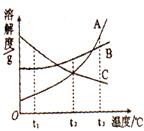
(1)t1℃时,A、B、C三种物质的溶解度依次为S1 g、S2 g、S3g。则S1、S2、S3这三个数中最大的是,最小的是。
(2)t2℃时,A物质的溶解度是S g,该温度下A的饱和溶液中,溶质的质量分数为 ;
( 3)将t3℃时等质量的A、B、C三种物质的饱和溶液降温至t2℃时,所得溶液中溶质的质量分数依次为a%、b%、c%,则a、b、c由大到小的顺序是 。
3)将t3℃时等质量的A、B、C三种物质的饱和溶液降温至t2℃时,所得溶液中溶质的质量分数依次为a%、b%、c%,则a、b、c由大到小的顺序是 。
答案:
(1)S3;S1
(2)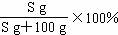
(3)b>a>c
思路分析:
考点解剖:本题考查溶解度及溶解度曲线的意义、溶质质量分数的计算等知识,中考重点题,中等难度。
解题思路:根据溶解度的意义、溶解度曲线的意义以及饱和溶液的定义、溶质质量分数的计算等分析解题。
解题过程:
解:
(1)由溶解度曲线可以看出,t1℃时,A、B、 C三种物质的溶解度由大到小依次是C、B、A,所以溶解度数值最大的是S3,最小的是S1。
C三种物质的溶解度由大到小依次是C、B、A,所以溶解度数值最大的是S3,最小的是S1。
 (2)t2℃时,A的溶解度是S g,即在100克水中最多溶解的溶质质量是S g,则溶质的质量分数为
(2)t2℃时,A的溶解度是S g,即在100克水中最多溶解的溶质质量是S g,则溶质的质量分数为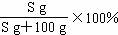 。
。
(3)t3℃时C的溶解度比t2℃时A、B的溶解度都小,而C的溶解度随温度降低而减小,所以C在t2℃时的溶质的质量分数和在t3℃时一样;t3℃时等质量的A、B的饱和溶液降温至t2℃时,溶解度都减小,溶液中都有晶体析出,所以在t2℃时A和B都是饱和溶液,B的溶解度比A大,且都大于C在t3℃时溶解度,所以B的溶质质量分数大于A,C的溶质的质量分数最小,即b>a>c。
规律总结:
溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。溶解度曲线有三个方面的应用:(1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况;(2)根据溶解度曲线,比较在一定温度范围内的物质的溶解度大小;(3)根据溶解度曲线,选择分离某些可溶性混合物的方法。
三、实验题(本大题包括2小题,共10分)
15、(4分〉实验室里用完酒精 灯后.熄灭火焰的正确方法是;
灯后.熄灭火焰的正确方法是;
用托盘天平称量5.8 gNaCl (1 g以下用游码)时,若药品放在了右盘.则所称NaCl的实际质量为 g;向一张洁白的滤纸上喷A时,无明显变化;再喷足量B时,出现了一个红色小猫图像;接着喷C时,小猫图像又消失了。已知A、B、C都是实验室常用的试剂。请推测滤纸上先绘制小猫图像的试剂是 ,A的pH
(选填代号:①等于7 ②大于7 ③小于7)。
16、(6分)下图是某课外活动小组同学设计的实验室制取CO2并检验其性质的装置示意图。请回答下列问题:
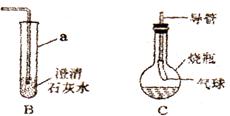
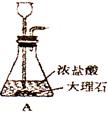
(1)代号a所指仪器名称是 ;A中的化学方程式为:;
(2)将A中产生的气体通入到B中一会儿,未见其中变浑浊,李祥同学认为这是浓盐酸挥发的HCl气体干扰所致。他用化学方程式表示为:
Ca(OH)2+CO2=CaCO3↓+H2OCaCO3+2HCl = CaCl2+H2O+CO2↑
你的解释可能更简捷,请用一个化学方程式表示:;
(3)张华同学用烧瓶收集A中产生的气体后,向其中加入过量的无色M溶液组成C装置振荡,发现气球中逐渐变大,且溶液始终无色透明。则M可能是(填写一种物质的化学式)
(4)请设计一个方案,验证C装置内反应的生成物中含有CO32-..简述实验过程:
;
(5)将A中药品换成过氧化氢溶液和二氧化锰,则该反应化学方程式为:。
答案:
(1)试管;CaCO3+2HCl=CaCl2+H2O+CO2↑;(2)Ca(OH)2+2HCl=CaCl2+2H2O;(3)KOH(或NaOH);(4)向其中加入BaCl2溶液,若生成白色沉淀,即可证明其中含CO32-[或:向其中加过量(或足量)的稀盐酸,若有气泡产生,则说明其中含CO32-];(5)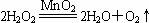
思路分析:
考点解剖:本题考查氧气和二氧化碳的制取原理及操作、浓盐酸的性质以及二氧化碳的性质等知识,中考重点题,中等难度。
解题思路:根据实验室制氧气和二氧化碳的药品和反应原理、碳酸根离子的检验方法、浓盐酸和二氧化碳的性质等分析解题。
解题过程:
解:
(1)代号a所指仪器的名称是试管;石灰石的主要成分是碳酸钙,和盐酸反应生成氯化钙和水、二氧化碳,反应的化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑。
(2)挥发出来的氯化氢气体和氢氧化钙反应生成了氯化钙,所以二氧化碳不能使其变浑浊,反应的化学方程式是:Ca(OH)2+2HCl=CaCl2+2H2O。
(3)由题意分析可知,A产生的二氧化碳被烧瓶中的液体反应吸收,则能反应吸收二氧化碳的是碱溶液,可以是KOH(或NaOH)。
(4)向其中加入BaCl2溶液,若生成白色沉淀,即可证明其中含CO32-[或:向其中加过量(或足量)的稀盐酸,若有气泡产生,则说明其中含CO32-]。
(5)过氧化氢和二氧化锰作用时,二氧化锰是催化剂,所以反应的化学方程式是: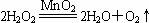 。
。
规律总结:
通证明碳酸根离子的方法有:和可溶性钡盐或钙 盐作用,看是否生成沉淀,或者是加入酸,看是否有气体产生。
盐作用,看是否生成沉淀,或者是加入酸,看是否有气体产生。
四、计算题(本大题包括1小题,共6分)
17、(6分〉随机取一定量的镁粉和铜粉的混合物于烧杯中,再向其中分次加入等质量的同一稀硫酸。实验过程中有关物质的用量及质量测定记录如下表:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量 | 35g | 35g | 35g | 35g |
剩余固体的质量 | 8.6g | 7.4g | 6.2g | 5.6g |
相对分子(原子)质量H2SO4-98MgSO4-120CuSO4-160Mg-24 Cu-64
请解答下列问题.
(1)随机所取镁粉和铜粉混合物的质量为g.其中m(镁): m(铜)= ;
(2)实验操作结束后的溶液中溶质的化学式为;
(3)所用稀硫酸中溶质的质量分数为 ;
(4)反应后所得溶液的总质量是多少(要有解答过程,结果精确到O.Olg)?
答案:
(1)9.8;3∶4;(2 )MgSO4、H2SO4;(3)14%;(4)143.85 g
)MgSO4、H2SO4;(3)14%;(4)143.85 g
思路分析:
考点解剖:本题考查金属活动性顺序表的应用;根据化学方程式的计算和溶液组成的计算,是一道图表分析计算问题,中考热点题,难度较大。
解题思路:根据镁和铜的金属活动性、质量守恒定律的应用、化学方程式的计算方法分析解题。
解题过程:
解:
(1)根据图表数据分析发现,第二、三次加酸,固体质量都减少1. 2 g,则第一次加35 g酸后固体也应减少1.2 g,所以原固体的质量=8.6 g+1.2 g=9.8 g;第四次加酸后质量只减少0.6 g,说明此时剩余的固体都是铜,为5.6克,则镁的质量=9.8 g-5.6 g=4.2 g,m镁∶m铜=4.2 g∶5.6 g=3∶4;
2 g,则第一次加35 g酸后固体也应减少1.2 g,所以原固体的质量=8.6 g+1.2 g=9.8 g;第四次加酸后质量只减少0.6 g,说明此时剩余的固体都是铜,为5.6克,则镁的质量=9.8 g-5.6 g=4.2 g,m镁∶m铜=4.2 g∶5.6 g=3∶4;
(2)由四次所加酸及剩余固体质量分析可知:35 g稀硫酸和1.2 g镁正好完全反应,而第四次只有0.6 g镁和35 g硫酸反应,所以硫酸剩余,则溶液中含有硫酸以及镁和硫酸反应生成的硫酸镁,即溶质为:MgSO4、H2SO4。
(3)由四次所加酸及剩余固体质量分析可知:35 g稀硫酸和1.2 g镁正好完全反应,设所用的稀硫酸的溶质 质量分数为x%,
质量分数为x%,
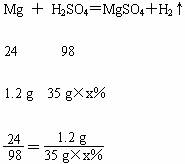
解得:x%=14%。
(4)由第(1)小题分析可知,参加反应的镁的质量是4.2 g,和硫酸完全反应后生成的是硫酸镁,此反应有氢气生成,设生成氢气的质量为y,
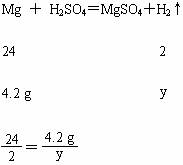
解得:y=0.35 g。
反应后所得溶液的总质量应为原固体的质 量(9.8克)加上所用的硫酸的质量(35 g×4=140克)减去生成的氢气(0.35克)和没有反应的铜的质量(5.6克),即反应后所得的溶液的总质量=9.8 g+35 g×4-5.6 g-0.35 g=143.85 g。
量(9.8克)加上所用的硫酸的质量(35 g×4=140克)减去生成的氢气(0.35克)和没有反应的铜的质量(5.6克),即反应后所得的溶液的总质量=9.8 g+35 g×4-5.6 g-0.35 g=143.85 g。
规律总结:
根据质量守恒定律,反应后生成的各物质总质量等于参加反应的各物质的总质量,若反应中有沉淀或气体生成,反应后溶液的质量=反应前溶液的总质量-生成的沉淀或气体的质量。



