(单词翻译:单击)
一、化学选择题(本题包括6个小题,共12分。每小题只有一个选项符合题意。)
1.2013年5月,全国科协年会在贵阳举行,其“生态文明与绿色发展”等相关内容为贵阳市生态文明城市建设注入了新的内涵。在生态文明城市建设中,下列做法不当的是
A.扩大湿地公园面积,改善空气质量 B.发展城市轨道交通,倡导低碳出行
C.大力发展火力发电,满足用电需求 D.学好化学科学知识,提升科学素养
2.对“桂花十里飘香”的下列解释正确的是
A.分子在不断运动 B.分子间有间隔 C.分子体积很小 D.分子质量很小
3.贵州盛产金银花,从金银花中提取的绿原酸(化学式为C16H18O9)有很高的药用价值。下列有关绿原酸的说法正确的是
A.绿原酸属于混合物 B.绿原酸由碳、氢、氧三种元素组成
C.绿原酸的相对分子质量为354g D.绿原酸中氢元素的质量分数最大
4.下列物质的用途与化学反应原理及反应类型对应不相符的是
选项 | 用途 | 化学反应原理(用方程式表示) | 基本反应类型 |
A | H2作燃料 | 2H2+O2 点燃 2H2O | 化合反应 |
B | 石灰石制生石灰 | CaCO3 高温 CaO+CO2↑ | 分解反应 |
C | CO用于炼铁 | 3CO+Fe2O3 高温 2Fe+3CO2 | 置换反应 |
D | Al(OH)3用于治疗胃酸过多 | Al( | 复分解反应 |
5.钠和氯气反应生成氯化钠的化学方程式为2Na+Cl2=2NaCl,反应的示意图如图1所示。则下列结论不正确的是

A.构成物质的粒子有原子、分子和离子
B.化学反应中原子得到或失去的是能量低的电子,并形成相对稳定结构
C.化学反应前后元素种类没有改变
D.元素呈现的化合价与反应中元素原子得失电子及数目有关
6.为 完成图2所示的四个实验中,编号处所指物质的选用正确的是
完成图2所示的四个实验中,编号处所指物质的选用正确的是

A.①木炭 B.②氮气 C.③浓硫酸 D.④氢氧化钠溶液
四、化学非选择题(本题包括7个小题,共48分)
35.一年的化学学习,我们感受到了化学的重要和化学的美,形成了一些化学观念。
(1)物质的多样性。人们发现和合成的物质已有几千万种。写出一种你熟悉的物质的类别和化学式_____ 。
(2)物质由微粒构成。如金刚石由碳原子构成,水由 ____构成。
(3)物质是变化的。如汽油挥发是物理变化,____是化学变化。
(4)物质间可以转化。如C可以转化为CO2,其转化的化学方程式为____。
(5)化学反应伴随能量变化。人类需要的大部分能量由化学反应产生。如酒精燃烧即是____反应(填“放热”或“吸热”)。
36.化学就在我们身边。

(1)土豆是我们喜爱的一种食品,图3所示是“家乡味土豆片”的主要营养成分。土豆中能为人体提供能量的营养素是____。多食用土豆和牛奶有利于身体健康,理由是____。
(2)土豆等农作物的生长需要化肥。下列化肥中属于氮肥的是____。
A.NH4Cl B.K2CO3 C.CO(NH2)2 D.Ca3(PO4)2
(3)贵阳市家用燃料的下列变迁,让我们认识了化学的重要价值。

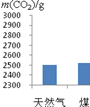
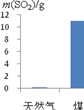
充分燃烧1kg天然气和煤所产生的CO2和SO2的质量如图4所示。为此,改用天然气作燃料的优点是_______。天然气(主要成分CH4)燃烧的化学方程式为_______。
(4)氢化镁(MgH2)固体可作为氢动力汽车的能源提供剂。提供能源时MgH2与水反应生成一种碱和氢气,反应的化学方程式为_______。
37.化学实验是学习化 学的重要方法。请完成下列金属性质的实验。
学的重要方法。请完成下列金属性质的实验。
(1)实验一:比较铁、铜的金属活动性强弱。请你设计实验完成下表内容。
实验步骤 | 实验现象 | 结 论 |
金属活动性:Fe>Cu |
(2)实验二:镁、锌、铁三种金属与酸的反应。
[实验]取一定量的镁、锌、铁三种金属分别加入到溶质质量分数相同的稀硫酸中,充分 反应,观察现象。
反应,观察现象。
[结论]活泼金属能与酸反应。
[分析]①三个反应的共同特点是__________,写出其中一个反应的化学方程式_________。
②若完全反应后,三个反应生成氢气的质量相等,原因是_________。
38.下表是KCl在不同温度时的溶解度。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶解度/g | 27.6 | 31.0 | 34.0 | 37.0 | x | 42.6 | 45.5 |
小明为测定x的值,取4份40℃的水各50g,分别进行实验,并记录数据如下表。
实验编号 | 实验1 | 实验2 | 实验3 | 实验4 |
KCl质量/g | 5 | 15 | 25 | 35 |
溶液质量/g | 55 | 65 | 70 | 70 |
请回答下列问题。
(1)实验中需要用到的仪器有_________(只写一种)。
(2)要使实验2的溶液达到饱和,可采取的方法是_________。
(3)由实验可知,40℃时KCl的溶解度x为 _________g。
(4)小 明现要配制质量分数为30%的KCl溶液100g,为达实验目的其主要操作是_________。
明现要配制质量分数为30%的KCl溶液100g,为达实验目的其主要操作是_________。
39.用图5和图6所示装置分别制取适量O2和CO2气体。请回答下列问题。
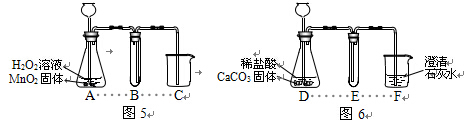
(1)A中MnO2的作用是_____________。
(2)写出A、D中发生反应的化学方程式,A:________;D:________。
(3)按实验要求完成下表内容( 不需要的可以不填)。
不需要的可以不填)。
制取气体 | 应加入的物质 | 物质或装置所起的作用 | |
O2 | B | ||
C | |||
CO2 | E | ||
F | 澄清石灰水 |
| |
40.某小组同学用盐酸和氢氧化钙,对酸和碱的中和反应进行探究。请你参与。
甲同学向装有氢氧化钙溶液的烧杯中加入盐酸,无明显现象。结论:两种物质未发生反应。
乙同学向滴有酚酞的氢氧化钙溶液的试管中慢慢滴加盐酸,溶液由________色变为无色。结论:两种物质发生了反应。反应的化学 方程式为________。
方程式为________。
大家认为乙的实验证明盐酸与氢氧化钙发生了中和反应。并对甲的实验 继续探究。
继续探究。
[提出问题]甲实验后的溶液中有什么溶质?
[作出猜想]猜想一,只有CaCl2;猜想二有CaCl2和Ca(OH)2;猜想三,有CaCl2和 HCl。
HCl。
[实验探究]为验证猜想,丙同学设计了方案1和方案2,并按方案进行实验。
方案编号 | 方案1 | 方案2 | 方案3 |
实验操作(分别取少量甲实验后的溶液于试管中) |
|
|
|
实验现象 | 对比标准比色卡:pH<7 | 产生白色沉淀 | |
实验结论 | 溶液中有HCl | 溶液中有CaCl2 |
[实验结论]丙认为猜想三正确。
[实验评价]丙的实验操作和方案中有不足之处,其不足之处是________。
大家讨论后通过方案3即证明了猜想三正确,其实验中应观察到的现象为________。
[实验拓展]为节约资源和避免实验废液对环境污染,小组同学将方案1和方案3及甲实验后烧杯中剩余溶液混合(混合时未见明显现象),并对混合液中的盐分离回收,请将相关内容填入下表。
要分离的盐 | 所用试剂 | 主要操作 |
41.通过电解水制得的氢气可用于电 子工业上制备高纯度硅。若要制得0.4kg氢气,理论上消耗水的质量是多少?(写出计算过程)
子工业上制备高纯度硅。若要制得0.4kg氢气,理论上消耗水的质量是多少?(写出计算过程)
贵阳市2013年初中毕业生学业考试试题卷
化学参考答案及评分标准
一、化学选择题(本题包括6个小题,共12分。每小题只有一个选项符合题意。)
1.C 2.A 3.B 4.C 5. B 6.D
四、化学非选择题(本题包括7个小题,除注明分数外,每个化学方程式2分,其余每空1分,共48分)
35.(6分)
(1)酸 H2CO3
(2)水分子
(3)蜡烛燃烧
(4)C+O2点燃CO2
(5)放热
 36.(8分)
36.(8分)
(1)糖类、蛋白质、油脂 营养丰富,均衡
(2)AC
(3)防止形成酸雨,保护环境 CH4+2O2点燃CO2+2H2O
(4)MgH2+2H2O=Mg(OH)2+2H2↑
37.(7分)
(1)
实验步骤 | 实验现象 | 实验结论 |
向硫酸铜溶液中投入铁钉 | 铁钉表面有红色固体析出,溶液由蓝色变为浅绿色 |
(2)①都是置换反应
Mg+H2SO4=MgSO4+H2↑或Zn+H2SO4=ZnSO4+H2↑或Fe+H2SO4=FeSO4+H2↑
②当三种金属过量,盐酸完全反应时,则生成氢气质量相等;当盐酸过量,三种金属完全反应,且质量比为mMg∶mZn∶mFe=24∶65∶56时,则生成氢气质量相等(2分)
38.(5分)
(1)烧杯
(2)增加溶质、降低温度、蒸发溶剂
(3)40
(4)水的温度升高至50℃以上,称取30gKCl固体溶于70g水中(2分)
39.(10分)
(1)作催化剂
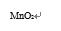
(2)A:2H2O2 === 2H2O+O2↑ D:CaCO3+2HCl=CaCl2+H2O+CO2↑
(3)
制取气体 | 应加入的物质 | 物质或装置所起的作用 | |
O2 | B | 水 | 排水收集氧气 |
C | 承接B中排出的水 | ||
CO2 | E | 收集二氧化碳 | |
F | 检验生成的CO2(或验满) | ||
40.(9分)
①红
②Ca(OH)2+2HCl=CaCl2+2H2O
③方案1中使用pH试纸的操作不对;方案2中加AgNO3产生白色沉淀说明溶液中有Cl-,并不能说明溶液中一定有CaCl2。(2分)
④先有气体产生,后有白色沉淀生成。
要分离的盐 | 所用试剂 | 主要操作 |
CaCl2 N | Na2CO3,HCl | 混合物中加入Na2CO3溶液至不再产生沉淀,过滤,将滤液蒸发即得NaCl;将过滤后的固体加稀盐酸至不再产生气体,对溶液加热蒸发即得CaCl2。 |
41.(3分)
【解】设:理论上消耗水的质量为x。
2H2O通电2H2↑+O2↑ 1分
36 4
x 0.4kg
36/ x = 4/0.4kg 1分
x=3.6kg 1分
答:理论上消耗水的质量为3.6kg。

 OH)3+3HCl=AlCl3+3H2O
OH)3+3HCl=AlCl3+3H2O

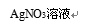
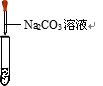
 aCl
aCl
