(单词翻译:单击)
试卷真题
一、选择题(本题有15小题,每题2分,共30分。每小题只有一个选项符合题意)
1.空气中体积分数最多的气体是
A.氮气 B.氧气 C.二氧化碳 D.稀有气体
2.下图所示的基本实验操作中错误的是
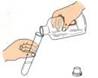
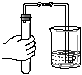


A.倾倒液体 B.检查气密性 C.收集二氧化碳气体 D.滴加少量液体
3.高锰酸钾(KMnO4)中钾的化合价为+1价,则锰元素的化合价是
A.+1 B.+4 C.+6 D.+7
4.下列反应中属于置换反应的是
A.
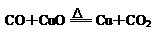 B.CaO + H2O
B.CaO + H2O Ca(OH) 2
Ca(OH) 2
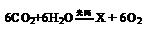 C.Zn+CuSO4 ZnSO4+Cu D.SO2+2NaOH Na2SO3+H2O
C.Zn+CuSO4 ZnSO4+Cu D.SO2+2NaOH Na2SO3+H2O
5. 化学反应 ,根据质量守恒定律确定X的化学式
A.C6H12 B.C6H12O C.C6H12O6 D.C3H6O3
6.下列化学现象的描述,错误的是
A.氢氧化钠固体溶于水吸热
B.红磷在空气中燃烧,产生大量白烟
C.分别蘸有浓盐酸与浓氨水的玻璃棒靠近产生白烟
D.细铁丝在氧气中燃烧,火星四射,生成黑色固体
7. 下列说法正确的是
A.用甲醛溶液浸泡海产品保鲜
B.化学纤维和羊毛可以用燃烧法区别
C.生物微量元素是人体必需的营养素,多吃无害
D.有机物都是含碳的化合物,CO、CO2 也是有机物
8.鉴别O2、CO、CO2三种气体,可行简便的方法是
A.将气体分别通入澄清石灰水 B.将气体分别通入石蕊试液
C.试验三种气体在水中溶解性 D.用燃着的木条分别伸入瓶内
9.把X、Y、Z三种金属片分别加入稀硫酸中,X、Y表面有气泡产生,Z无变化;把X加入Y的硫酸盐溶液中,X表面析出Y。则三种金属活动顺序为
A.Y> X >Z B.X >Y> Z C.Z>Y>X D.X>Z>Y
10.观察下图,化石燃料在燃烧过程中会产生各种废气,其中形成酸雨的主要气体是
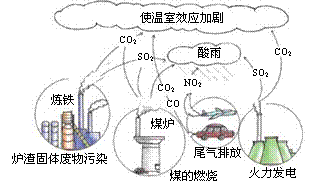
A.SO2、NO2 B. CO2、CO C.SO2、CO2 D.NO2、CO
11. 少年儿童按下图时间就餐,口腔残留食物的pH在一天中的变化如下:
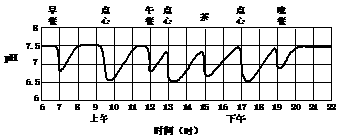
已知口腔若经常保持酸性,容易发生蛀牙,如果只从这一点考虑,你认为三次刷牙时间最好安排在
A.三次吃点心后 B.早、午、晚餐前
C.早餐、午餐、晚睡前 D.早、午、晚餐后
12.下列各组物质分别加入足量的水中,能得到无色透明溶液的是
A.FeCl3、NaOH、NaCl B.Na2SO4、HCl、BaCl2
C.CuSO4、KCl 、HCl D.Na2CO3、NaCl、Na2SO4
13. 一种抗生素为粉末状固体,每瓶含0.5 g,注射时应配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水
A.1.5mL B.2mL C.3mL D.4mL
14.下列知识整理的内容不完全正确的一组是
A.化学与安全 | B.化学与生活 |
稀酸溅入眼睛——用大量水冲洗 进入地窖——先做灯火实验 | 除去餐具上的油污——用洗洁精乳化 人体需要适量补钙——防止患甲状腺疾病 |
| D.化学与环保 |
化石燃料——煤、石油和天然气 清 | 减少汽车尾气污染——提倡使用公共交通等 减少温室气体排放——利用水力、核能发电 |
15.除去下列各物质中的 少量杂质,所选用的试剂及操作方法均正确的是
少量杂质,所选用的试剂及操作方法均正确的是
选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
A | C02(CO) | 02 | 点燃 |
B | NaCl溶液(CaCl2) | 适量的Na2CO3溶液 | 过滤 |
C | NH3(H2O) | 足量的浓H2SO4 | 洗气 |
D | CuO(Cu) | 适量的稀盐酸 | 过滤、洗涤、干燥 |
二、不定项选择(1-2个答案)(6分)
16.某溶液恒温蒸发掉部分溶剂后,无晶体析出,下列说法正确的是( )
A. 原溶液可能是饱和溶液 B. 剩余的溶液一定是不饱和溶液
C. 剩余的溶液可能是饱和溶液 D. 剩余的溶液与原溶液中的溶质的质量分数可能相等
17.将质量相等、溶质质量分数相同的两份稀硫酸分装在甲、乙两个烧杯中,再称取质量相等的铝和锌,把铝放入甲烧杯中,锌放入乙烧杯中。待反应结束后,发现甲烧杯中铝有剩余,乙烧杯中的锌已全部反应,根据此现象推断,下列结论中,正确的是( )
A. 一定是乙烧杯中产生的氢气多 B. 可能乙烧杯中产生的氢气多
C. 可能甲烧杯中产生的氢气多 D. 可能甲、乙两烧杯中产生的氢气一样多
18.某班甲、乙两组同学分别做常见酸和碱与指示剂反应的实验,使用的试剂有稀盐酸、稀硫酸、氢氧化钠溶液和酚酞试液。实验后废液分别集中到各组的一个废液缸中。研究小组对两个组的废液进行检测,结果如下表。下列说法错误的是(不考虑酚酞和水)

A.甲组废液中一定含有稀盐酸和稀硫酸
B.乙组废液中一定含有氢氧化钠、氯化钠、硫酸钠
C.直接将甲组的废液排入铸铁管下水道,可能腐蚀铸铁水管
D.将两组的废液处理后再排放,防止污染
二、填空题(本题有5小题,共22分)
15.(5分)回答下 列问题:
列问题:
(1)请用化学用语表示: 3个钾原子_________,2个氮分子_________;
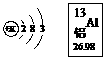
(2)右图是铝的结构示意图和在周期表中的位置图,则铝原子的核电荷数是_________,铝元素的相对原子质量是_________;
(3)物质①牛奶②食醋③蔗糖④矿泉水,其中属于纯净物的是_________(填序号)。
16.(5分)依据所学的化学知识解答:
(1)将墨汁滴入一杯清水中,清水很快变黑,说明 _______________;
(2)铁在空气中容易生锈,这是因为_______________(用化学方程式表示),防止铁制品锈蚀的方法有_______________(写一种即可);
(3)若装白磷的储罐起火,可以用水灭火,也可以用沙土填埋灭火。其中用沙土填埋灭火的原理是______。
17. (4分)右图是某化肥包装袋上的部分说明:

(1)碳酸氢铵保存时注意事项是_________________;
(2)将碳酸氢铵和氢氧化钙混合研磨就会发生反应,并可闻到刺激性气味。请写出该反应的化学方程式_________________;闻到的刺激性气味的气体是氨气,它能使润湿的红色石蕊试纸变______色。
18. (4分)右图是三种固体物质的溶解度曲线。请你根据曲线回答下列问题:
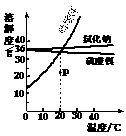
(1)氯化钠和硫酸锂在0℃时的溶解度是___________g;
(2)在20℃时,P点表示硝酸钾的___________溶液(填“饱和”或“不饱和”),若要将硝酸钾从溶液中结晶析出,可采用___________。
(3)将硝酸钾和硫酸锂的饱和溶液,从20℃降温到10℃,有晶体析出的是___________。
19.(4分)现有一包白色粉末,可能是食盐、纯碱或干燥剂(主要成分生石灰)中的一种或几种物质组成。为了研究白色粉末的组成,进行了如下实验:
(1)将部分粉末放入烧杯中,加适量水充分搅拌后,得澄清溶液,溶液温度升高,滴加酚酞试液,溶液变红,得出:粉末中一定含有___________,可能有___________;
(2)向(1)中澄清溶液滴加过量稀硝酸,然后再滴加硝酸银溶液,发现有白色沉淀生成,请你写出该反应的化学方程式___________。
三、(本题有2小题,共16分)
20.(8分)某食盐样品中含有少量沙土、氯化钙和氯化镁。以下是除去食盐样品中沙土、氯化钙和氯化镁的实验流程:
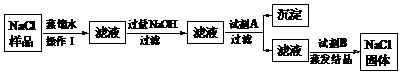
根据流程图回答:
(1)操作Ⅰ的名称是__________,加入的试剂A是__________,沉淀是__________;
(2)写出NaOH与杂质反应的化学方程式__________;
(3)加入试剂B的目的是__________;
(4)蒸发结晶时用到玻璃棒的作用是 __________ 。
四、(本题有2小题,共22分)
21.(14分)请根据下图回答问题:
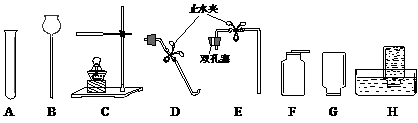
(1)仪器A的名称是 ____________,仪器B的名称是____________。
(2)用KClO3与MnO2混合制取和收集纯净O2,应选用上图中的____________(填序号),反应的化学方程式____________。
(3)实验室制取和收集CO2,应选用上图中的____________(填序号),反应的化学方程式____________;如何检验已集满一瓶CO2气体____________。
(4)右图为某同学组装的制取H2并还原CuO的实验装置,请你指出其中的错误

①____________;
②____________;
③____________。
22.(8分)在做盐跟盐反应的分组实验时,第一组学生进行BaCl2与Na2CO3溶液的反应,第二组学生进行BaCl2与Na2SO4溶液的反应。实验结束后,两组同学将全部的浊液集中倒进一个废液缸中。浊液中白色沉淀物质是_________和___________。
化学兴趣小组对浊液进行过滤,探究滤液的成分。
【提出问题】滤液里除了NaCl外,还有什么物质?
【提出猜想】
猜想①:___________;猜想②:Na2SO4;
猜想③:Na2CO3; 猜想④:Na2CO3、Na2SO4

【实验探究】
若现象a只有白色沉淀,则猜想 ___________成立;若现象a只有气泡产生,则猜想___________可能成立;若现象b产生白色沉淀,然后加稀硝酸沉淀部分溶解,并产生气泡,则猜想___________成立,若沉淀全部不溶解,则猜想___________成立。
五、(本题有2小题,共12分)
23.(5分)2011年我国女科学家屠呦呦发现青蒿素(青蒿素的化学式:C15H22O5),它是一种用于治疗疟疾的药物,获美国拉斯克奖。
(1)青蒿素分子由___________种元素构成。
(2)一个青蒿素分子含有___________个原子。
(3)青蒿素分子中C、H、O三种元素的质量比为___________。
25.(7分)实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如右图所示。
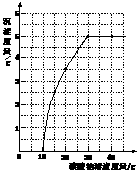
回答下列问题:
(1)从图中看出生成沉淀的最大质量是__________g。
(2)开始加入碳酸钠溶液至10g时,还没有沉淀的原因是__________。
(3)计算原滤液中氯化钙的质量分数。
试题答案
参考答案及评分标准
说明:1.提供的答案除选择题外,不一定是唯一答案,对于与此不同的答案,只要是合理的,同样给分。
2.评分说明是按照一种思路与方法给出作为参考。在阅卷过程中会出现各种不同情况,可参考本评分说明,作出具体处理,并相应给分。
3.化学方程式的书写中,化 学式正确给1分;其中不配平、错漏条件和“↑”“↓”任一种、两种或三种情况扣1分。
学式正确给1分;其中不配平、错漏条件和“↑”“↓”任一种、两种或三种情况扣1分。
一、选择题(本题包括14小题,每小题2分,共28分)
1.A 2.D 3.D 4.C 5.C 6.A 7.B 8.D 9.B 10.A 11.A 12.D 13.B 14.B 15.B 16.C 17CD 18.A
二、填空题(本题有5小题,共22分)
15.(1)3K(1分) 2N2(1分)
(2)13(1分) 26.98 (填27也给分)(1分) (3)③ (1分)
16.(1)分子在不断运动(1分)
 (2)4Fe+3O2 2Fe2O3(2分)
(2)4Fe+3O2 2Fe2O3(2分)
涂油(或喷漆、搪瓷、电镀等合理即可)(1分)
(3)隔绝白磷与空气接触(1分)
17.(1)密封保存,防潮防晒(1分)
 (2)NH4HCO3+Ca(OH)2 CaCO3+2H2O+NH3↑(2分) 蓝(1分)
(2)NH4HCO3+Ca(OH)2 CaCO3+2H2O+NH3↑(2分) 蓝(1分)
18.(1)36(1分)
(2)不饱和(1分) 蒸发溶剂法(或降温结晶法)(1分)
(3)硝酸钾饱和溶液(1分)
19.(1)干燥剂(或CaO或生石灰同样给分)(1分) 食盐(或NaCl)(1分)
 (2)NaCl + AgNO3 AgCl ↓ + NaNO3 (2分)
(2)NaCl + AgNO3 AgCl ↓ + NaNO3 (2分)
 (或CaCl2 + 2AgNO3 2AgCl ↓ + Ca(NO3)2 或同时写两个反应均可)
(或CaCl2 + 2AgNO3 2AgCl ↓ + Ca(NO3)2 或同时写两个反应均可)
三、(本题有2小题,共16分)
20. (8分)
(1)过滤(1分) 碳酸钠(或Na2CO3)(1分)
碳酸钙(或CaCO3)(1分)
 (2)2NaOH+MgCl2 Mg(OH)2↓+2NaCl(2分)
(2)2NaOH+MgCl2 Mg(OH)2↓+2NaCl(2分)
(3)除去NaOH 和Na2CO3 (2分)(只答对1个给1分, 2个全对给满分)
和Na2CO3 (2分)(只答对1个给1分, 2个全对给满分)
(4)搅拌,防止局部过热导致残留物飞溅(1分)
四、(本题有2小题,共22分)
21.(14分)
(1)试管(1分) 长颈漏斗(1分)
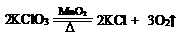
(2)ACDH(2分)
(3)ABEF(2分)
 CaCO3 + 2HCl CaCl2 + H2O + CO2↑(2分) 将燃着的木条伸到集气瓶口,若火焰熄灭,则已集满(1分)
CaCO3 + 2HCl CaCl2 + H2O + CO2↑(2分) 将燃着的木条伸到集气瓶口,若火焰熄灭,则已集满(1分)
(4)①长颈漏斗未插入液面下(1分)
②盛CuO的试管口未向下倾斜(1分)
③通H2的导管未伸到装CuO的试管底部(1分)(写改正错误的也给分)
22.(8分)
BaSO4(1分) BaCO3 (1分)
【提出猜想】BaCl2(2分)
【实验探究】①(1分) ③④(1分) ④(1分) ②(1分)
五、(本题有2小题,共12分)
23.(5分)(1)3(1分) (2)42(2分) (3)90:11:40 (2分)
24.(7分)
(1)5(2分)
(2)稀盐酸先与碳酸钠反应。(1分)
(3)解:设原滤液中CaCl2的质量为x
Na2CO3+CaCl2 = CaCO3↓+ 2NaCl ………………………………………(1分)
| ……………………………………………………(1分) |
111 100
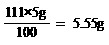
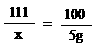 x 5g
x 5g
x= …………………………(1分)

原滤液中CaCl2的质量分数= ……………………………(1分)
答:原滤液中氯化钙的质量分数是11.1%。

 C.化学与能源
C.化学与能源
