(单词翻译:单击)
试卷真题
一.选择题(本大题10题,每题2分,只有一个选项最符合题意)
1.下列变化中属于化学变化的是
A.榨取果汁 B.粉碎废纸 C.切割玻璃 D.燃放烟花
2.PM2.5是指大气中直径小于或等于2.5微米的颗粒物。PM2.5漂浮在空中,进入人体肺泡,对健康影响很大。PM2.5属于下列空气污染物中的
A.可吸入颗粒物 B.一氧化碳 C.二氧化硫 D.二氧化氮
3.空气成分中体积分数最大的是
A.氧气 B.氮气 C.二氧化碳 D.稀有气体
4.下列物质属于纯净物的是
A.海水 B.水泥砂浆 C.干冰 D.汽水
5.把少量下列物质分别加入水中,充分搅拌后不能得到溶液的是
A.蔗糖 B.氯化钠 C.酒精 D.花生油
6.下列实验操作中正确的是
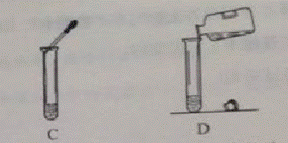
7.硅酸钠(Na2SiO3)可用作粘合剂和防火材料。硅酸钠中硅元素的化合价为
A.+1 B.+2 C.+3 D.+4
8.稀土元素是一类有重要用途的资源。铈(Ce)是一种常见的稀土元素,下列有关说法错误的是

A.铈的原子序数是58
B.铈属于非金属元素
C.铈原子中的质子数是58
D.铈的相对原子质量是140.1
9.下列关于实验现象的描述,正确的是
A.硫在氧气中的燃烧,发出微弱的淡蓝色火焰
B.面馅在空气中燃烧时,产生烧焦羽毛气味的气体
C.细铁丝在氧气中燃烧时,火星四射,生成黑色固体
D.红磷在空气中燃烧时,产生大量白色烟雾
10.燃料电池是一种新型绿色电池。它是把H2、CO、CH4等燃料和空气不断输入,直至被氧化,使化学能转变为电能的装置。这三种气体可以作为燃料的燃料的原因是
A.均是无毒无害的气体 B.均可燃烧并放出大量的热
C.燃烧产物均为二氧化碳 D.均在自然界中大量存在
二.选择题(本大题5题,每题2分,每小题四个选项中,有1-2个符合题意)
11.生活离不开化学,下列选项中合理的是
A.青少年适量补铁,可以预防佝偻病
B.服用含有氢氧化铝的药物,治疗胃酸过多症
C.为了节约粮食,把霉变大米淘洗后食用
D.食用甲醛浸泡过的海产品,可提高人体免疫力
12.下表列出了除去物质中所含少量杂质的方法,其中正确的选项是正确的是

13.甲乙丙三种物质间通过一步反应能实现右图转化,下列选项符合图式转化关系的是
A.用水区分碳酸钙粉末和碳酸钠粉末
B.用水区分硝酸铵固体和氢氧化钠固体
C.用硝酸钡溶液区分稀盐酸和稀硫酸
D.用酚酞溶液区分稀盐酸和食盐水
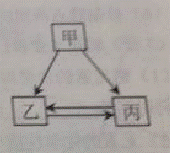
14.甲乙丙三种物质间通过一步反应能实现右图转化,下列选项中符合转化关系的是
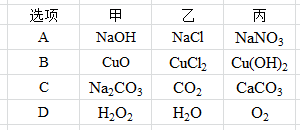
15.现有锌和另一种金属组成的混合物,把6.5g该混合物加入到100g一定溶质质量分数的稀 硫酸中,恰好完全反应,产生氢气的质量为w。则下列说法中正确的是
硫酸中,恰好完全反应,产生氢气的质量为w。则下列说法中正确的是
A.若混合物为Zn、Al,w可能是0.2g
B.若混合物为Zn、Fe,w不可能是0.2g
C.若混合物为Zn、Cu,w是0.1g,则该混合物中锌的质量分数为50%
D.若混合物为Zn、Mg,则加入的稀硫酸中溶质质量分数一定大于10%
第II卷 非选择题(70分)
三.填空题(本大题有3小题,共20分)
16.(6分)化学就在我们身边,它能改善我们的生活。请从下列物质中,选择适当的物质填空(填序号)
①干冰 ②肥皂水 ③食盐 ④硝酸钾 ⑤碳酸钾 ⑥石墨
(1)可用于炒菜调味的是_____________
(2)可用于人工降雨的是______________
(3)可用与区别硬水和 软水的是______________
软水的是______________
(4)属于复合肥料的是______________
(5)可用作干电池电极的是__________
(6)配置高点所用的发酵粉的主要成分之一是_______________
17.(7分)铝在工业和日常生活中应用广泛。请回答:
(1)铝元素的含量居地壳中所有元素的第________位。将铝块拉成细丝,是利用铝的_________性。
(2)铝元素的化学性质与原子的最外层电子数有密切关系。右图为铝原子的结构示意图,铝原子在化学反应中容易_________(填“得到”或“失去”)电子。 
(3)铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化,因此铝具有很好的抗腐蚀性能。写出铝与氧气反应的化学方程式:_____________________________________。
(4)冰晶石在工业制取金属铝的过程中起着重要的作用。硫酸铝和氟化钠(NaF)在熔融条件下反应生成冰晶石(Na3AlF6),同时得到硫酸钠,写出此反应的化学方程式____________________________________。
18. (7分)构成物质的粒子之间的关系如右图所示:
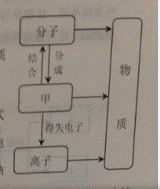
(1)甲是_________;
(2)在水,汞,氯化钠三物质中,由离子组成的物质是_________保持水化学性质的最小粒子是_____________。
(3)电解水试验可证明水的组成,其反应的 化学方程式为______________________。在该
化学方程式为______________________。在该 实验中,加入少量硫酸钠可增强水的导电性(在通电前后硫酸钠的质量和性质不变),现有0.2g硫酸钠溶解在99.8g水中并通电,当溶液中硫酸钠的质量分数为0.25%时,有______g水被电解。
实验中,加入少量硫酸钠可增强水的导电性(在通电前后硫酸钠的质量和性质不变),现有0.2g硫酸钠溶解在99.8g水中并通电,当溶液中硫酸钠的质量分数为0.25%时,有______g水被电解。
四.简答题(本大题有3小题,共20分)
19.(6分)按要求书写方程式:
(1)氧化钙和水反应:__________________________。
(2)高锰酸钾受热分解:___________________________。
(3)氢氧化钠溶液与盐酸反应 :_________________________________。
:_________________________________。
20.(8分)甲乙丙三中固体物质的溶解度曲线如右图所示,回答下列问题。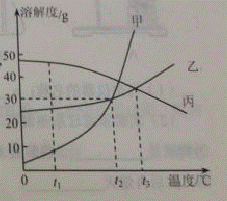
(1)t1℃时,甲乙丙三物质的溶解度由大到小的顺序是_____________。
(2)t2℃时,甲和乙的溶解度______(填“相等”或“不相等”)。
(3)t2℃时,甲物质的饱和溶液中溶质与溶剂的质量比为_________。(写最简比)
(4) t3℃将乙和丙两种物质的饱和溶液降低到t1℃,所得溶液中溶质的质量分数大小关系为:乙_____丙(填“>”、“<”或“=”)。
21.(6分)在下图有关物质转化关系中,各物质均是初中化学常见的物质,其中A为红色金属单质,B能参与植物的光合作用。C、D为黑色粉末,F为可用于改良酸性土壤的碱,G为难溶性物质,H为难溶性蓝色物质(图中部分生成物已省略)。
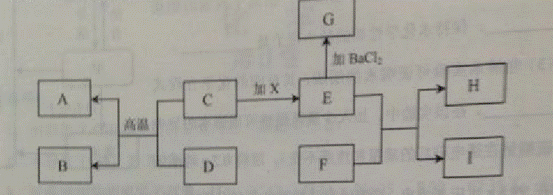
(1)用化学式表示: D_________ G___________
(2)写出E与F反应的化学方程式__________________ _______
_______
(3)光合作用生成的淀粉在人体内变成葡萄糖(C6H12O6),葡萄糖在酶的催化作用下发生缓慢氧化,同时放出热量,写出葡萄糖发生缓慢氧化反应的化学方程式_________________________________
五.实验题(本大题2小题,共22分)
22.(7分)请结合下列实验装置,回答有关问题。
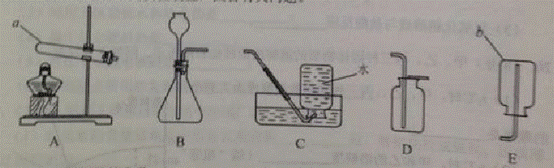
(1)写出仪器名称 a__________ b_____________ CO2.
(2)实验室通过加热混有二氧化锰的氯酸钾固体制取氧气,在该反应中起催化作用的物质是_________.将装置A和C链接进行此实验,应现将导管移出水面,然后熄灭__________。
(3)实验室若用石灰石和稀盐酸制取并收集二氧化碳,选用的装置为_________(填字母),加试剂前,连接装置并检查装置的______________。将二氧化碳通入盛有蒸馏水的试管中,该试管中溶液的pH_______7(填“>”、“<”或 “=”)
“=”)
23.(4分)化学实验中经常用到一定溶质质量分数的溶液Na2CO3溶液也呈碱性。请回答:
实验室配制质量分数4%的氯化钠溶液50g。需要固体氯化钠的质量为_______g,水为__________mL(水的密度1g/cm3)。
若用质量分数为8%的氯化钠溶液配制50g质量分数为4%的氯化钠溶液。
①要 8%的氯化钠溶液的质量为_________g。
8%的氯化钠溶液的质量为_________g。
②该溶液配制过程中除用到量筒、玻璃棒和胶头滴管外,还需要的仪器是______________。
24.某钢铁厂高炉炼铁的主要原料是焦炭,赤铁矿石(主要含Fe2O3)、空气等,主要反映过程如下:

请回答:
A的化学式___________。
反应②的化学方程式_______________。
反应③的化学方程式________________。
向硝酸银和硝酸铜的混合溶液中,加入一定量的铁粉,反应停止后过滤,得到滤渣和滤液。向滤渣中滴加稀盐酸,无气泡产生,则滤渣中一定含有_________(填化学式),滤液中一定含有的溶质是_________(填化学式)。
用含杂质的铁10g(杂质不溶于水,也不参加反应)与100g稀硫酸恰好完全反应,滤去杂质,得到滤液质量为108.1g,则含杂质的铁中,铁的质量分数为_________________。
六.计算题(本大题2小题,共10分)
25.(3分)维生素C(C6H8O6)主要存在于蔬菜,水果中,它能促进人体生长发育,增强人体对疾病的抵抗力。计算:
(1)维生素C的相对分子质量__________________
(2)维生素C中碳、氢两种元素的质量比___________________(写最 简比)
简比)
(3)维生 素C中______元素的质量分数最大。
素C中______元素的质量分数最大。
26.(7分)某混合物中含有碳酸钙和氯化钙,取该混合物6g,向其中加入一定质量的质量分数为10%的稀盐酸,恰好完全反应,产生2.2g气体。(假设气体全部逸出)。
计算:
(1)所取混合物中碳酸钙的质量。
(2)所加稀盐酸的质量
(3)反应后所得溶液中的质量分数(计算结果精确到0.1%)
试题答案
一、选择题(本大题共10小题,每小题2分,共20分.每小题给出的四个选项中,只有一个最符合题意)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
选项 | D | A | B | C | D | A | D | B | C | B |
二、选择题(本大题共5小题,每小题2分,共10分.每小题给出的四个选项中,有1~2个符合题意)
题号 | 11 | 12 | 13 | 14 | 15 |
选项 | B | AC | D | CD | BC |
三、填空题(20分)
16.(6分)
(1)③ (2)① (3)② (4)④(5)⑥(6)⑤
17.(7分)
(1)三 延展
(2)失去
(3)4 Al+3O2=2Al2O3
Al+3O2=2Al2O3
(4)Al2(SO4)3 +12NaF共融 2Na3AlF6 +3Na2SO4
18.(7分)
(1)原子
(2)氯化钠 水分子
(3)2H2O通电 2H2↑+ O2 ↑ 20
四、简答题(共20分)
19.(6分)
( 1) CaO + H2O = Ca(OH)2
1) CaO + H2O = Ca(OH)2
(2)2KMnO4 △ K2MnO4 + MnO2 + O2↑
(3) NaOH + HCl = NaCl +H2O
HCl = NaCl +H2O
20.(8分)
(1)丙 乙 甲 (2)相等 (3)3:10 (4)<
21. (6分)
(1)C BaSO4
(2)CuSO4 + Ca(OH)2 = Cu(OH)2↓+CaSO4 
(3)C6H1 2O6 + 6O2 酶 6CO2 + 6H2O
2O6 + 6O2 酶 6CO2 + 6H2O
五、实验题(本大 题共3题,共20分)
题共3题,共20分)
22.(7分)
(1)试管 集气瓶
(2)二氧化锰 酒精灯
(3)BD 气密性 <
23.(4分)
(1)2 48 (2)25 ‚烧杯
24.(9分)
(1)CO 2
2
(2)C + CO2高温2CO
 (3)3CO+ Fe2O3高温2Fe +
(3)3CO+ Fe2O3高温2Fe +
 3CO2
3CO2
(4)Ag Fe(NO3)2
(5)84%
六、计算题(本大题共2题,共10分)
25.(3分)
(1)176
(2)9:1
(3)氧
26.(7 分)
分)
解:设所取混合物中CaCO3的质量为x,所加稀盐酸中溶质的质量为y,生成的CaCl2的质量为z
 CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
100 73 111 44
111 44
x y z 2.2g

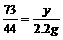
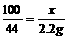
x=5g y=3.65g z=5.55g
所加稀盐酸的质量为:3.65÷10%=36.5g
反应后所得溶液中溶质的质量:(6g-5g)+5.55g=6.55g
反应后所得溶液质量为:6g+36.5g-2 .2g=40.3g
.2g=40.3g
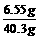 反应后所得溶液中溶质的质量分数: ×100%=16.3%
反应后所得溶液中溶质的质量分数: ×100%=16.3%
答:略


