(单词翻译:单击)
一、选择题(本题有~20小题,第1-10题每小题3分,第11- 20题每小题4分。每小题只有一个选项是正确的,不选、多选、错选均不给分)
4.将铁、铜分别放入稀硫酸中,铁表面有气泡产生,而铜表面无明显现象.通过这一现象可以判断( )
A.铁的导电性比铜强 B.铁的金属活动性比铜强
C.铁的导电性比铜弱 D.铁的金属活动性比铜弱
类别 | 物质 |
甲 | 氯化钠、水 |
乙 | 氧气、铜 |
5.根据物质的组成,小明将部分物质分为甲、乙两类(如表所示).下列对分类结果判断正确的是 ( )
A.甲为化合物,.乙为单质 B.甲为单质,乙为化合物
C.甲为氧化物,乙为金属 D.甲为金属r乙为氯化物
6.近日,某省发现部分大米镉超标,镉超标易引起镉中毒.镉元素的核电荷数为48,相对原子质量为112,则镉原子的核外电子数是 ( )
A.48 B.64 C.112 D.160
13.金属钒(V)被誉为“合金的维生素”,可由V2O5冶炼得到。V2O5中氧元素的化合价为-2,则钒元素的化合价为 ( )
A.+2 B.—2 C.+5 D.-5
16.高氯酸是已知酸中最强的酸,一定溶质质量分数的高氯酸加热到92℃以上会发生爆炸,其化学方程式为:4,HClO4 2Cl2↑+7O2↑+2H2O,该反应的类型属于( )
2Cl2↑+7O2↑+2H2O,该反应的类型属于( )
A.化合反应 B.分解反应C.复分解反应 D.置换反应
20.科学知识与生产生活联系紧密.下列物质用途错误的是( )
选项 | A | B | C | D |
物质 | 氯化钠 | 二氧化碳 | 浓硫酸 | 氧气 |
用途 | 除铁锈 | 用于火火 | 作干燥剂 | 供给呼吸 |
二、简答题(第21- 23题每空2分,第24-27题每空3分)
22.温州水上台阁是一种供观赏用的龙舟.
(1)台阁的龙头龙尾是由楠木精雕细琢而成.雕刻过程中;楠木发生的变化是_________变化.
23. 2012年8月,“好奇”号火星车成功着陆火星表面,人类探索火星又迈进了一步.
(2)火星车的重要任务是寻找火星上支持生命存在的证据之一——有机物.有机物在组成上的共同特点是都含有 _________元素。
24.阿斯匹林的主要成分是乙酰水杨酸(化学式为C9H8O4),具有抑制血小板发挥作用的功能,是治疗心血管疾病的重要药物之一.
(1)乙酰水杨酸中氢、氧两种元素的质量比为_________.
(2)乙酰水杨酸具有酸性,若在其无色溶液中滴入紫色石蕊试液,观察到溶液呈_________色.
26.废电池随意丢弃不仅造成环境污染,还会造成资源浪费.废电池内的黑色物质含有碳、二氧化锰、氯化铵等物质.氯化饺浓溶液可用于去除某些金属表面的氧化物。某研究小组要回收和利用废电池内的氯化铵,进行如下实验:
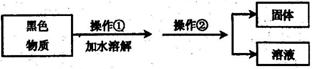
(1)操作②的名称是_____________ .
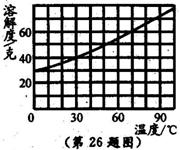
(2)小组同学欲配制30℃的氯化铵饱和溶液来去除金属表面的氧化物,查氯化铵的溶解度曲线图(如图)可知:30℃时,100克水中最多能溶解_____________克氯化铵。
(3)用氯化铵(NH4Cl)浓溶液去除某金属表面氧化物(氧化物化学式用MO表示),其反应原理为:
2NH4Cl十MO MCl2+2NH3↑+X,则物质X的化学式为 _____________。
MCl2+2NH3↑+X,则物质X的化学式为 _____________。
三、实验探究题
28.小明和小红利用右图装置,以碳酸钙和稀盐酸为原料来制取二氧化碳气体,并进行比较分析。
(1)小明用图甲和图乙组合来制取二氧化碳气体.如何检验二氧化碳是否收集满?请写出具体操作:_________________________.

(2)小红认为用图丙收集二氧化碳气体的方法比图乙更好.你认为她的理是:_________________________。(写出一点)
(3)实验过程中小红发现反应有快慢,请你列举一种判断反应快慢的方法:_________________________.
30:气体的密度容易受温度和压强的影响.为了测量常温常压下氧气的密度,在老师的指导下,小明进行了如下实验:
步骤一:检查发生装置的气密性.
步骤二:往烧瓶中装入适量的二氧化锰粉末,关闭分液漏斗的活塞,并将适量的过氧化氢溶液倒入分液漏斗中,测出发生装置的总质量为m1克.
步骤三:取一个集气瓶,用记号笔在适当位置做标记,将水注入集气瓶到标记处,用量筒测出这些水的体积为V0毫升.再将集气瓶灌满水倒扣在水槽中等待收集。
步骤四:打开活塞,滴入过氧化氢溶液,同时开始收集气体.调节集气瓶在水中的上下位置,当集气瓶内、外的液面相平且刚好达到标记处时(如图),暂停反应.
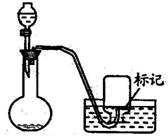
步骤五:重复步骤四,再收集9瓶气体.
步骤六;称出反应后发生装置的总质量为m2克.
(1)小明通过该实验,测得氧气的密度是_____________克/毫升。
(2)步骤四中,控制集气瓶内、外液面保持相平的目的是_____________。
(3)如果实验中装置气密性不良,将对测得的密度值有何影响?请说明理由:_____________.
四、分析计算题(本题8分)
35.小明在老师的指导下测一瓶稀盐酸的溶质质量分数,具体步骤如下:
步骤一:配制溶质质量分数为1%的氢氧化钠溶液.
步骤二:向20克待测稀盐酸中逐滴滴入上述氢氧化钠溶液,并使用pH计记录溶液的pH变化情况,绘制图像如右图。

(1)在步骤一中需要用到的玻璃仪器有_______________。(写出两种)
(2)已知发生反应的化学方程式为:NaOH+HCl=NaCl+H2O,请结合右图,计算该稀盐酸的溶质质量分数.(结果精确到0.01%)
(3)在往稀盐酸中逐渐滴人氢氧化钠溶液的过程中,当溶液的pH,达到2时,溶液中的溶质有_______________。(用化学式表示)
参考答案
一、选择题(本题有~20小题,第1-10题每小题3分,第11- 20题每小题4分。每小题只有一个选项是正确的,不选、多选、错选均不给分)
4.B5.A6.A 9.D13.C 16.B20.A
二、简答题(第21- 23题每空2分,第24-27题每空3分)

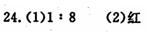

三、实验探究题


四、分析计算题(本题8分)



