(单词翻译:单击)
参考答案
2014年大纲版高考理综真题试卷附答案
一、选择题
1、下列有关细胞核的叙述,错误的是( )
A.蛋白质是细胞核中染色质的组成成分
B.细胞核中可进行遗传物质的复制和转录
C.小分子物质可以通过核孔,大分子物质不能
D.有丝分裂过程中存在核膜消失和重新形成的现象
2.ATP是细胞中重要的高能磷酸化合物。下列有关ATP的叙述,错误的是( )
A.线粒体合成的ATP可在细胞核中发挥作用
B.机体在运动时消耗ATP,睡眠时则不消耗ATP
C.在有氧与缺氧的条件下细胞质基质中都能形成ATP
D.植物根细胞吸收矿质元素离子所需的ATP来源于细胞呼吸作用
3、下列关于人体淋巴细胞的叙述,错误的是( )
A.在胸腺中发育成熟的T淋巴细胞可参与细胞免疫
B.效应T淋巴细胞可攻击被病原体感染的宿主细胞
C.T淋巴细胞和B淋巴细胞都是由造血干细胞发育成的
D.T细胞释放的淋巴因子不能使受到抗原刺激的B细胞增殖
4.某同学在①、②、③三种条件下培养大肠杆菌,这三种条件是:
①以葡萄糖为碳源的培养基,不断补充培养基,及时去除代谢产物
②以葡萄糖为碳源的培养基,不断补充培养基,不去除代谢产物
③以葡萄糖和乳糖为碳源的培养基,不补充培养基,不去除代谢产物


甲 乙 丙
A.甲、乙、丙 B.乙、丙、甲 C.丙、甲、乙 D. 丙、乙、甲
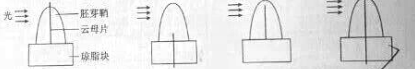
5.为验证单侧光照射会导致燕麦胚芽鞘中生长素分布不均匀这一结论,需要先利用琼脂块收集生长素,之后再测定其含量。假定在单侧光照射下生长素的不均匀分布只与运输有关。下列收集生长素的方法(如图所示)中,正确的是( )
二、非选择题

31.(9分)植物的光合作用受多种因素的影响。回答下列问题:
(1)右图表示了 对某种C3植物和某种C4植物 的影响。当光照强度大于p时,C3植物和C4植物中光能利用率高的是 植物。通常提高光能利用率的措施有 的面积,补充 气体等。
(2)在光合作用过程中,C4植物吸收的CO2被固定后首先形成 化合物。
(3)C3植物光合作用的暗反应需要光反应产生的ATP和NADPH,这两种物质在叶绿体内形成的部位是 。NADPH的中文简称是 ,其在暗反应中作为 剂,用于糖类等有机物的形成。
32.(9分)小肠的吸收是指食物消化后的产物。水和无机盐等通过小肠上皮细胞进入血液和淋巴的过程。0.9%的NaCl溶液是与兔的体液渗透压相等的生理盐水。某同学将处于麻醉状态的兔的一段排空小肠结扎成甲、乙、丙、丁四个互不相同、长度相等的肠袋(血液循环正常),并进行实验,实验步骤和实验结果如表:

请根据实验结果回答问题:
(1)实验开始时,水在肠腔和血液之间的移动方向是:甲组从 ;丙组从 。在这一过程中水分子的运动方向是从容液浓度 处流向溶液浓度
处。本实验中水分子的这种移动过程称为 。
(2)比较乙和丁的实验结果,可推测小肠吸收Na+时,需要 的参与。
33.(10分)现有A、B两个密闭、透明的生态瓶,其生物组成和光照条件见下表。一段时间后,发现A瓶的生态系统较B瓶稳定。
生态瓶编号 | 光照 | 含微生物的泥沙 | 浮游藻类 | 水草 | 浮游动物 |
A | + | + | + | + | + |
B | - | + | + | + | + |
注“+”表示有,“-”表示有。
请回答:
(1)A瓶中微生物、浮游藻类、水草和浮游动物共同组成了一个 ,浮游藻类和水草的种间关系为 。
(2)一段时间后,B瓶中浮游藻类种群密度 ,原因是 ;浮游动物的种群密度 ,原因是 。
(3)生态系统中分解者的作用是 。
34.(14分)现有4个小麦纯合品种,即抗锈病无芒、抗锈病有芒、感锈病无芒、感锈病有芒,已知抗锈病对感锈病为显性,无芒对有芒为显性,且这两对相对性状各由一对等位基因控制。若用上述四个品种组成两个杂交组合,使其F1均为抗锈病无芒,且这两个杂交组合的F2表现型及其数量比完全一致。回答问题:
(1)为实现上述目的,理论上,必需满足的条件有:在亲本中控制这两对相对性状生物两对等位基因必须位于 ,在形成配子时非等位基因要 ,在受精时雌雄配子要 ,而且每种合子(受精卵)的存活率也要 。那么。这两个杂交组合分别是 和 。
(2)上述两个杂交组合的全部F2植株自交得到F3种子,1个F2植株上所结的全部F3种子种在一起,长成的植株称为1个株系。理论上,在所有F3株系中,只表现出一对性状分离的株系有4种,那么,在这4种株系中,每种株系的表现型及其数量比分别是 , , 和 。
2014年普通高等学校招生全国统一考试(全国大纲卷)
理科综合能力测试化学部分
第I卷
6.下列叙述正确的是
A.锥形瓶可用作加热的反应器
B.室温下,不能将浓硫酸盛放在铁桶中
C.配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏高
D.用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低
7.NA表示阿伏加德罗常数,下列叙述正确的是
A. lmol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L0.5 mol • L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na202固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6 NA
8.下列叙述错误的是
A. SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同
B.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸
C.用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率
D.用AgNO3溶液可以鉴别KC1和KI
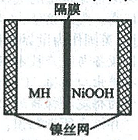
9.右图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池)。下列有关说法不正确的是
A.放电时正极反应为:NiOOH+H2O+e-→Ni(OH)2+OH-
B.电池的电解液可为KOH溶液
C.充电时负极反应为:MH+OH-→+H2O+M+e-
D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高
10.下列除杂方案错误的是
选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A. | CO(g) | CO2(g) | NaOH 溶液、浓 H2SO4 | 洗气 |
B. | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
C. | Cl2(g) | HCl(g) | 饱和食盐水、浓H2SO4 | 洗气 |
D. | Na2CO3(s) | NaHCO3(s) | — | 灼烧 |
11.下列离子方程式错误的是
A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++ SO42 - =BaS04↓+2H2O
B.酸性介质中KMnO4氧化 H2O2:2MnO4- +5H2O2+6H+ = 2Mn2++5O2↑+ 8H2O
C.等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓
D.铅酸蓄电池充电时的正极反应:PbSO4 + 2H2O-2e- = PbO2+4H++SO42 -
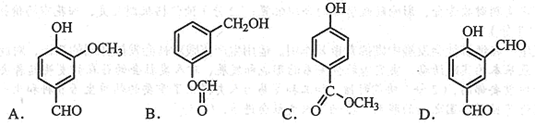
12.从香荚豆中提取的一种芳香化合物,其分子式为C8H8O3,遇FeCl3溶液会呈现特征颜色,能发生银镜反应。该反应可能的结构简式是
13.已知:将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且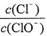 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是A.若某温度下,反应后
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是A.若某温度下,反应后 =11,则溶液中
=11,则溶液中 =2
=2
参加反应的氯气的物质的量等于2amol
C.改变温度,反应中转移电子的物质的量ne的范围:2amol≤ne≤6amol
D.改变温度,产物中KC1O3的最大理论产量为7amol
 amol第II卷
amol第II卷
27.(15分)
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是 ,写出一种工业制备单质F的离子方程式 。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为 ,其水溶液与F单质反应的化学方程式为 ;在产物中加入少量KI,反应后加人CC14并振荡,有 机层显 色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A的二元离子化合物 |
b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
c | 化学组成为BDF2 |
d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为 ;b的化学式为 ;;c的电子式为 ;
d的晶体类型是 。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过 键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为 。
)
28.(15分)
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、
c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为
;实验a和c的平衡转化率:αa为 、αc为 。
29.(15 分)
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
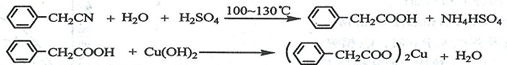
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
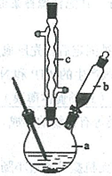
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是 ;仪器c的名称是 ,其作用是 。
反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是 。下列仪器中可用于分离苯乙酸粗品的是 (填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是 ,最终得到44 g纯品,则苯乙酸的产率是 。
(4)用CuCl2 • 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是 。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 。
30.(15 分)
“心得安”是治疗心脏病的药物,下面是它的一种合成路线(具体反应条件和部分试剂略):
回答下列问题:
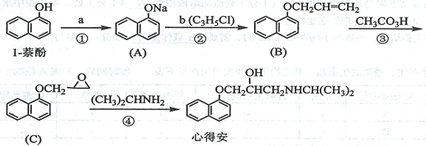
(1)试剂a是 ,试剂b的结构简式为 ,b中官能团的名称是 。
(2)③的反应类型是 。
(3)心得安的分子式为 。
(4)试剂b可由丙烷经三步反应合成:

反应1的试剂与条件为 ,
反应2的化学方程式为 ,
反应3的反应类型是 。(其他合理答案也给分)
(5)芳香化合物D是1-萘酚的同分异构体,其分子中有两个官能团,能发生银镜反应,D能被KMnO4酸性溶液氧化成E( C2H4O2) 和芳香化合物F (C8H6O4),E和F与碳酸氢钠溶液反应均能放出CO2气体,F芳环上的一硝化产物只有一种。D的结构简式为 ;
由F生成一硝化产物的化学方程式为 ,
该产物的名称是 。
2014年全国全国统一招生考试大纲卷物理部分
二、选择题:本题共8小题,每小题6分。在每小题给出的四个选项中,有的只有一项符合题目要求,有的有多项符合题目要求。全部选对的得6分,选对但不全的得3分,有选错的得0分。
14.—质点沿x轴做直线运动,其I/-?图像如图所示。质点在/ = 0时位于x = 5m处,开始沿x轴正向运动。当k 8s.时,质点在轴上的位置为
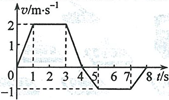
A. x = 3m B. x= 8m
C. a: = 9m D. x- 14m
15.地球表面附近某区域存在大小为150N/C、方向竖直向下的电场。一质量为1.00xl0_4kg、带电量为-1.00x10—7C的小球从静止释放,在电场区域内下落10.0m。对此过程,该小球的电势能和动能的改变量分别为(重力加速度大小取9.80m/s2,忽略空气阻力)
A. -1.50x10_4J 和 9.95x10_3J B. 1.50 x 10_4J 和 9.95 x 10_3J
C. — 1.50x10_4J 和 9.65x10-3J D. 1.50 x 10_4J 和 9.65 x 10_3J
16.对于一定量的稀薄气体,下列说法正确的是
A.压强变大时,分子热运动必然变得剧烈 B.保持压强不变时,分子热运动可能变得剧烈
C.压强变大时,分子间的平均距离必然变小 D.压强变小时,分子间的平均距离可能变小
17.在双缝干涉实验中,一钠灯发出的波长为589nm的光,在距双缝1.00m的屏上形成干涉图样。图样上相邻两明纹中心间距为0.350cm,则双缝的间距为
A. 2.06x 10"7m B. 2.06x 10"4m C. 1.68x 10'4m '
18.两列振动方向相同、振幅分别为扃和决的相干简谐横波相遇。下列说法正确的是
A.波峰与波谷相遇处质点的振幅为⑷-先|
B.波峰与波峰相遇处质点离开平衡位置的位移始终为肩+ A2
C.波峰与波谷相遇处质点的位移总是小于波峰与波峰相遇处质点的位移
D.波峰与波峰相遇处质点的振幅一定大于波峰与波谷相遇处质点的振幅
19.一物块沿倾角为<9的斜坡向上滑动。当物块的初速度为〃时,上升的最大高度为//,如图所示;当物块的初速度为|时,上升的最大高度记为A。重力加速度大小为g。物块与斜坡间的动摩擦因数和h分别为

A. tan 0和与 B. tan 0和与2 {2gH ) 2
20.很多相同的绝缘铜圆环沿竖直方向叠放,形成一很长的竖直圆筒。一条形磁铁沿圆筒的中心轴竖直放置,其下端与圆筒上端开口平 齐。让条形磁铁从静止开始下落。条形磁铁在圆筒中的运动速率 A.均勻增大 B.先增大,后减小 C.逐渐增大,趋于不变 D.先增大,再减小,最后不变
答:C
21.—中子与一质量数为A (A>1)的原子核发生弹性正碰。若碰前原子核静止,则碰撞前与碰撞后中子的速率之比为 答:A

三、非选择题:第22〜34题,共174分。按题目要求作答。
22.(6 分)
现用频闪照相方法来研究物块的变速运动。在一小物块沿斜面向下运动的过程中,用频闪相机拍摄的不同时刻物块的位置如图所示。拍摄时频闪频率是10Hz;通过斜面上固定的刻度尺读取的5个连续影像间的距离依次为&、x2、x3、x4。已知@面顶端的高度/z和斜面的长度〜数据如下表所示。重力加速度大小g = 9.80m/s2。
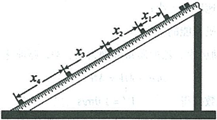

根据表中数据,完成下列填空:
物块的加速度a= m/s2(保留3位有效数字)。
⑵因为 可知斜面是粗糙的。
23.(12分)现要测量某电源的电动势和内阻。可利用的器材有:电流表®,内阻为1.000; 电压表®;阻值未知的定值电阻凡、.及2、及3、及4、尺5;开关S;—端连有鳄鱼夹P的 导线1,其他导线若干。某同学设计的测量电路如图U)所示。
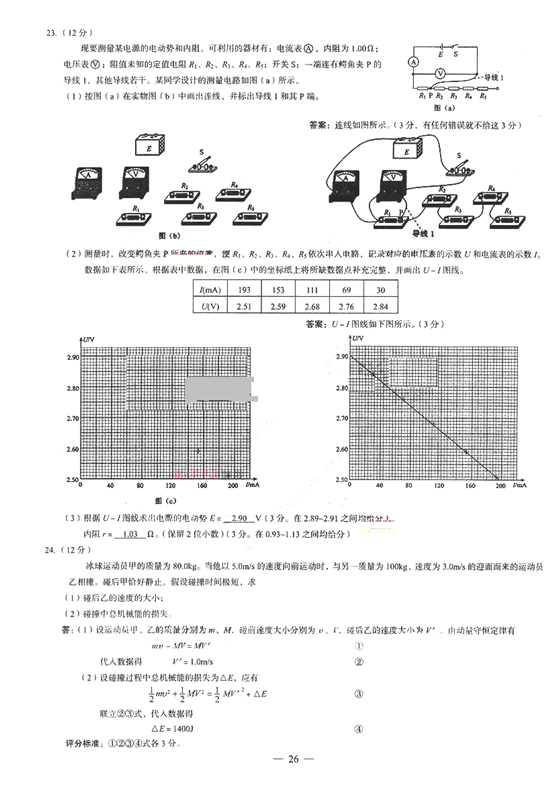
(1)按图(a)在实物图(b)中画出连线,并标出导线1和其P端。
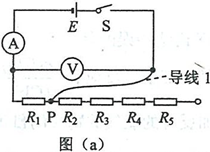
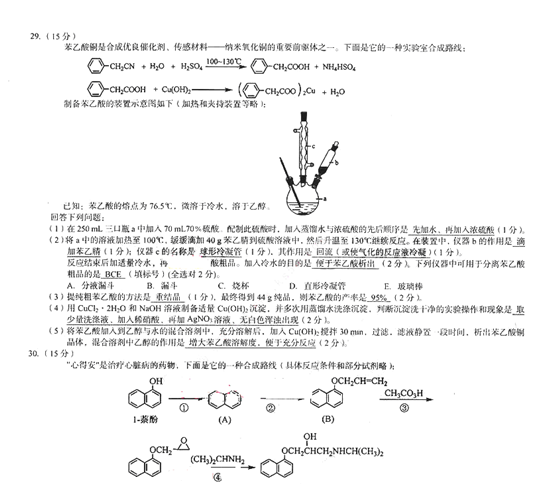
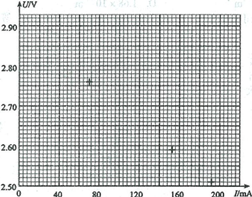
(2)测量时,改变鳄鱼夹P所夹的位置,使及、R2、R3、及4、办依次串入电路,记录对应的电压表的示数t/和电流表的示数/。 数据如下表所示。根据表中数据,在图(c)中的坐标纸上将所缺数据点补充完整,并画出C/-/图线。

24.(12 分)
冰球运动员甲的质量为80.0kg。当他以5.0m/s的速度向前运动时,与另一质畺为100kg、速度为3.0m/s的迎面而来的运动员 乙相撞。碰后甲恰好静止。假设碰撞时间极短,求:
(1 )碰后乙的速度的大小;
(2)碰撞中总机械能的损失。
25.(20 分)如图,在第一象限存在匀强磁场,磁感应强度方向垂直于纸面(吁平面)向外;在第四象限存在匀强电场,方向沿x轴负向。在;;轴正半轴上某点以与X轴正向平行、大小为w的速度发射出一带正电荷的粒子,该粒子在(d,0)点沿垂直于x轴的方向进人电场。不计重力。若该粒子离开电场时速度方向与轴负方向的夹角为<9,求<>
(1 )电场强度大小与磁感应强度大小的比值;
(2)该粒子在电场中运动的时间。
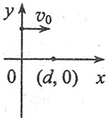
参考答案