(单词翻译:单击)
第Ⅰ卷(选择题共24分)
一、 选择题(每小题3分,共24分)在每小题给出的四个选项中,只有一项是符合题目要求的。
1、下列图示的实验中,正确的是( )
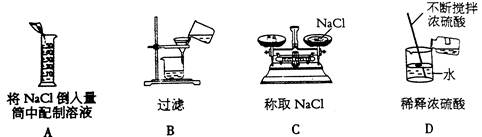
2、化学与生活、生产、科技密不可分,下列叙述正确的是( )
A、合金、塑料、玻璃钢属于合成材料 B、用甲醛浸泡过的水产品,可放心食用
C、研制新材料、新能源替代传统能源,减少污染 D、化肥硝酸铵可与碱性物质混合使用,增大肥效
3、最近,“镉大米”成为公众关注的热点问题之一。据了解,含镉的大米对人的肝肾损害比较大。镉(Cd)的原子序数为48,中子数为64,下列说法错误的是( )
A、镉原子的质子数为48 B、镉原子的相对原子质量为112g
C、镉是金属元素 D、镉原子的核外电子数为48
4、下列离子能在pH=11的溶液中大量共存的是(  )
)
A、K+、NO3-、Na+、OH- B、CO32-、K+、Cl-、Ca2+
C、H+、Ba2+、Cl-、SO42- D、K+、OH-、SO42-、Cu2+
5、只用一种试剂就可一次性鉴别稀硫酸、KOH溶液、CaCl2溶液的是( )
A、KCl溶液 B、K2CO3溶液 C、稀盐酸 D、NaNO3溶液
6、在反应3CO+Fe2O3===2Fe+3CO2中,铁元素的化合价由+3价变为0价,碳元素的化合价由+2价变为+4价。这类在化学反应前后有化合价变化的反应属于氧化还原反应。据此判断,下列反应不属于氧化还原反应的是( )
A、2H2+O2===2H2O B、Fe+CuSO4 = FeSO4+Cu
C、2H2O2===2H2O+O2↑ D、Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O
7、下列图像与对应选项关系合理的是( )
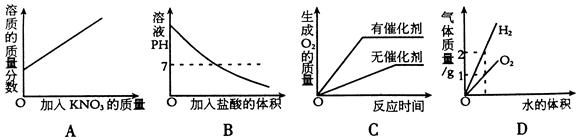
A、在某温度下,向一定量接近饱和的硝酸钾溶液中,不断加入硝酸钾晶体
B、向NaOH溶液中滴中稀盐酸至过量
C、用相等质量的双氧水来制取氧气
D、电解水生成氢气和氧气
8、某不纯的铁5.6g与足量的稀硫酸充分反应,生成0.21g氢气,则铁中混有的金属可能是( )
A、Zn B、Cu C、Mg D、Ag
第Ⅱ卷(非选择题共51分)
二、填空题(本题7个小题,共27分)
9、(4分)从C、H、N、Cl、Fe五种元素中,选择适当元素符号按要求填空。
⑴用适当的符号和数字填空。①2个氮气分子 ②氯化亚铁中的阳离子 。
⑵写出符合下列要求的物质的化学式。①最简单的有机物 ②含氯元素的氮肥
10、(4分)加强对空气质量的监测是保护环境的一项重要措施,下表是达州市一年四季空气质量监测的平均数据。请你据表回答下列问题。
可吸入颗粒物(TSP) | 氮氧化合物(NO2等) | 二氧化硫(SO2) | 空气质量级别 | |
春季 | 88 | 40 | 44 | Ⅱ |
夏季 | 67 | 33 | 36 | Ⅱ |
秋季 | 90 | 46 | 54 | Ⅱ |
冬季 | 98 | 69 | 60 | Ⅱ |
⑴对我市空气质量影响最大的指标是 。
⑵空气质量最差的季节是 。
⑶你认为造成这种情况的原因是 。(答一点即可)
⑷可采取的有效防治措施是 。(答一点即可)
11、(3分)下列是明朝诗人于谦的《石灰吟》: ①千锤万凿出深山,②烈火焚烧若等闲,
③粉身碎骨浑不怕,④要留清白在人间。
⑴诗中隐含物理变化的诗句是 。(填序号)
⑵请写出诗中所涉及的化学方程式 。
12、(2分)2.3g某物质在空气中完全燃烧,生成4.4g二氧化碳和2.7g水,则该物质中一定含有 元素(填元素符号),其质量比为 。
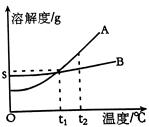
13、(3分)A、B两物质的溶解度曲线如图所示,请根据曲线回答下列问题:
⑴t1℃时,A的饱和溶液中溶质与溶液质量比 ;
⑵若B中含有少量A,应用 法提纯B;
⑶若将A的饱和溶液从t2℃降温到t1℃时,一定不会发生改变的是 。
A.溶解度 B.溶剂质量 C.溶质质量 D.溶质质量分数
14、(5分)有一包白色粉末,可能含有Ba(OH)2、KNO3、FeCl3、Na2CO3、Na2SO4中的一种或几种。为了确定其成分,进行如下实验:
①取一定量的白色粉末加入足量的水,振荡,静置,得白色沉淀,上层清液为无色。
②过滤,在白色沉淀中加入足量稀盐酸,白色沉淀全部溶解,且有气泡产生。
⑴据此推断,该白色粉末中一定含有 ;可能含有 ;一定不含有 。
⑵写出步骤②中发生反应的的化学方程式: 。
15、(6分)实验室要制取一瓶纯净、干燥的二氧化碳气体,请根据以下装置回答下列问题。
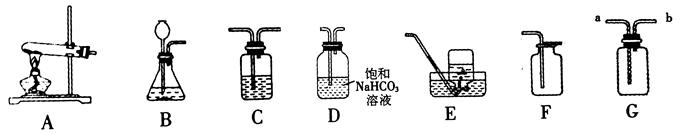
⑴发生装置应选 (填写装置的字母代号)。
⑵用F装置而不用E装置收集二氧化碳的原因是 。
⑶若用G装置来收集二氧化碳,气体应从 端进入(填a或b)。
⑷若要用C装置来干燥二氧化碳,C装置中应盛放的物质是 。
⑸D装置通常用来除去二氧化碳中混有的少量氯化氢气体,请写出化学方程式
。
三、实验探究题(本题2个小题,共16分)
16、(8分)日常生活中使用的塑料袋,有的是用聚乙烯制成的,有的是用聚氯乙烯制成的。小凤对包装食品的塑料袋进行探究,以验证其成分。
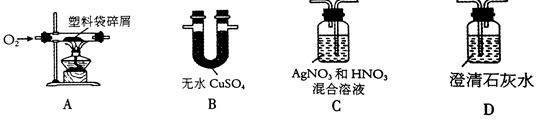
【作出猜想】:①该塑料袋是用聚乙烯制成的 ②该塑料袋是用聚氯乙烯制成的;
【查阅资料】:聚乙烯燃烧生成二氧化碳和水;聚氯乙烯燃烧生成二氧化碳、水和氯化氢;无水硫酸铜是白色粉末,遇水变为蓝色。
【实验探究】:小凤将装置按A、B、C、D顺序连接好后,进行实验。在实验过程中,B、D产生明显现象,C无明显现象,说明塑料袋没有 气体生成(填化学式)。B装置的作用是 ;D瓶中发生反应的化学方程式是 。
【实验结论】:通过实验证明,猜想 是正确的。
【交流反思】:①从化学角度分析,大量使用塑料制品会导致 。
②连接实验仪器时,能否 (填“能"或“不能”)将B、C位置进行交换,理由是
17.(8分)同学们在学习Ca(OH)2的化学性质时,对Ca(OH)2溶液和Na2CO3溶液反应后溶液中溶质的成分进行探究。请你一同探究并回答下列问题:
【提出问题】:滤液中的溶质是什么物质?溶液呈中性。
【查阅资料】:①Ca(NO3)2溶液呈中性。 ②Ca(NO3)2 +Na2CO3= CaCO3↓+2NaNO3
【猜想假设】:甲同学认为:只含有NaOH; 乙同学认为:只含有NaOH Ca(OH)2;
丙同学认为:含有NaOH Ca(OH)2 Na2CO3; 你认为可能含有 。
【分析讨论】:丁同学认为 同学的猜想肯定是不合理的,理由是 。
【实验设计】:请你设计一个简单的实验来验证你的猜想是正确的。
实验步骤 | 实验现象 | 实验结论 |
取滤液于试管中
| 猜想正确 |
甲同学也针对自己的猜想进行了如下实验。
实验步骤 | 实验现象 | 实验结论 |
取滤液于试管中滴加少量的稀盐酸 | 无明显现象 | 猜想正确 |
你认为甲同学的实验结论是否正确 (填正确或不正确),理由是 。
【反思拓展】:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑
。
四、计算题(本题1个小题,共8分)
18、(8分)现有含HCl和CuCl2的混合溶液50g,向该溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图所示。
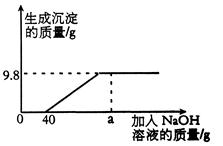
⑴当加入NaOH溶液质量为ag时,溶液中的溶质有 ;
⑵求混合溶液中CuCl2的质量分数。
⑶求恰好完全反应时,消耗NaOH溶液的总质量。
达州市2013年高中阶段教育学校招生统一考试
化学参考答案及评分意见
第Ⅰ卷(选择题 共24分)
一、选择题(每小题3分,共24分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
答案 | D | C | B | A | B | D | B | C |
第Ⅱ卷(非选择题 共51分)
二、填空题(本题7个小题,共27分)除特殊说明的,每空1分。
9、⑴①2N2 ②Fe2+ ⑵①CH4 ②NH4Cl
10、⑴可吸入颗粒物 或TSP ⑵冬季 ⑶冬季天气较冷,取暖所用煤的量增大 / ……
⑷作用清洁燃烧 / 大量植树造林 / ……
11、⑴① ⑵CaCO3===CaO+ CO2↑ CaO+H2O = Ca(OH)2 Ca(OH)2+CO2 = CaCO3↓+H2O 此空,只要写对其中的两个都算2分。
12、C、H、O 12:3:8
13、⑴S:(100+S) ⑵蒸发结晶 ⑶B
14、⑴Ba(OH)2、Na2CO3 KNO3 FeCl3、Na2SO4 ⑵BaCO3+2HCl = BaCl2+H2O+CO2↑ (2分)
15、⑴B ⑵二氧化碳能溶于水,且密度比空气大。 ⑶a
⑷浓硫酸 ⑸NaHCO3+HCl = NaCl+H2O+CO2↑ (2分)
三、实验探究题(本题2个小题,共16分)
16、【实验探究】: HCl 验证是否有水生成 Ca(OH)2+CO2 = CaCO3↓+H2O(2分)
【实验结论】: ①
【交流反思】:①白色污染 ②不能 如果将B、C位置进行交换,气体从C中出来再检验到有水分,就不能充分说明水是燃烧时生成的,还是从C装置中带出来的。
17.【分析讨论】:丙 Ca(OH)2 与Na2CO3不能共存。
【实验设计】:
实验步骤 | 实验现象 | 实验结论 |
取滤液于试管中 加入足量Ca(NO3)2溶液或氯化钙溶液,再滴加无色酚酞试液 | 先有白色沉淀生成,滴加酚酞后溶液变为红色 | 猜想正确 |
不正确。滴加少量的稀盐酸,如果氢氧化钠还没有反应完,盐酸就不可能与碳酸钠反应,也就不可能产生气泡。
【反思拓展】:反应物是否过量或不足。
四、计算题(本题1个小题,共8分)
18、⑴NaCl、NaOH
⑵设CuCl2的质量为X,消耗NaOH溶液的质量为Y。
CuCl2+2NaOH = Cu(OH)2↓+2NaCl
135 80 98
X Y·10% 9.8g
= = X=13.5g Y=80g
混合溶液中CuCl2的质量分数=×100%=27%
⑶恰好完全反应时,消耗NaOH溶液的总质量=40g+80g =120g。
答:略


