(单词翻译:单击)
一、选择题(本题共15小题,每小题只有一个选项符合题意。每小题2分,共30分)
1.空气中含量最多的气体是
A.氮气 B.氧气 C.二氧化碳 D.水蒸气
2.NO中氮元素的化合价为
A.+2 B.+1 C.-2 D.—1
3.地壳中含量最多的元素是
A.铝 B.铁 C.硅 D.氧
4.下列图示实验操作中,正确的是
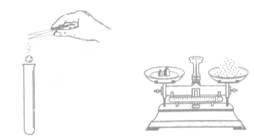

A.加入大理石 B.称量固体 C.熄火酒精灯 D.过滤
5.下列化肥中,属于钾肥的是
A.尿素 B.碳酸氢铵 C.硫酸钾 D.过磷酸钙
6.下列物质中,属于合成纤维的是
A.棉花 B.涤纶 C.羊毛 D.蚕丝
7.下列物质中,属于纯净物的是
A.粗盐 B.糖水  C.黄铜 D.氢气
C.黄铜 D.氢气
8.在元素周期表中锡元素的某些信息如图所示,下列有关锡的说法正确的是

A.属于非金属元素 B.原子序数为50
C.相对原子质量是118.7g D.原子核内中子数为50
9.下列食物的近似pH如下,其中酸性最强的是
A.鸡蛋清7.6-8.0 B.柠檬2.2-2.4 C.西红柿4.0-4.4 D.牛奶6.3-6.6
10.丁二酮(C4H6O2)可用作糖果增香剂。下列关于丁二酮的说法中正确的是
A.丁二酮属于有机高分子化合物 B.丁二酮中含有氧分子
C.丁二酮中氧元素的质量分 数最大 D.丁二酮中氢元素的质量分数为6.98%
数最大 D.丁二酮中氢元素的质量分数为6.98%
11.下列实验不能 成功的是
成功的是
A.用肥皂水检验软水和硬水 B.用食醋区分食盐和小苏打
C.将冷碟子放在蜡烛火焰的上方,得到炭黑 D.加熟石灰粉末研磨,区分氯化铵和硫酸铵
12.下列粒子结构示意图中,表示阴离子的是

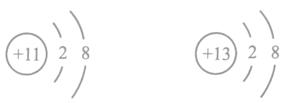
A. B. C. D.
13.根据化学方程式不能获得的信息是
A.该反应中的反应物和生成物 B.化学反应的快慢
C.反应发生所需要的条件 D.参加反应的各粒子的相对数量
14.下列各组离子在水中能大量共存的是
A.Na+、Ba2+、SO42— B.H+、 Cu2+、OH—
Cu2+、OH—
C.K+、NO3—、Cl— D.H+、CO32—、Cl—
15.甲、乙两种不含结晶 水的固体物质的溶解度曲线如下图,下列说法中正确的是
水的固体物质的溶解度曲线如下图,下列说法中正确的是
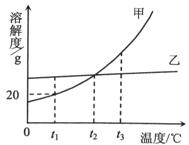
A.甲的溶解度比乙大
B.t1℃时,甲的饱和溶液中溶质与溶液的质量比为1∶5
C.t2℃时,甲、乙的两种饱和溶液中溶质的质量分数相等
D.将等质量甲、乙的两种溶液分别由t3℃降温至t2℃,析出甲的质量一定比析出乙的质量大
二、(本题包括2小题,共19分)
16.(8分)根据下列装置图,回答有关问题:
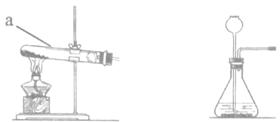
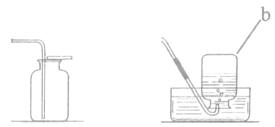
A B C D
(1)写出装置图中标号仪器的名称:a ________;b________;
(2)写出实验室用H2O2制取氧气的化学方程式________,可选刚的发生装置是________(填字母)。
(3)若使用高锰酸钾制取氧气,可选用的发生装置是________( 填字母)。
填字母)。
(4)选用D装置收集氧气的原因是________。
17.(11分)实验室中常需要使用硫酸。
(1)用小木棍蘸少量浓硫酸,放置—会儿后,可观察到________。
(2)98%的浓硫酸稀释为稀硫酸时,一定要将________沿烧杯壁缓慢地注入盛有的烧杯里,并用________搅拌,此时若用手轻轻触碰烧杯外壁,有________的感觉。
(3)49g质量分数为20%的稀硫酸与足量锌反应,最多生成氢气的质量是多少?
(在答题卡上写出计算过程)
三、(本题包括1小题,共8分)
18.(8分)能源与环境已成为人们日益关注的问题。
(1)目前人们利用最多的能源是煤、________和天然气等化石燃料。
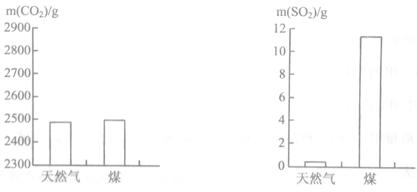
(2)充分燃烧1000g天然气和煤所产生的CO2和SO2气体的质量如下图所示,根据图示分析,下列说法正确的是 ________。
A.煤燃烧产生的气体更易导致酸雨 B.该天然气中不含硫元素
C.煤燃烧对环境影响较小 D.煤和天然气的燃烧都有温室气体产生
(3)人们正在利用和开发其他能源,如太阳能、________ 、________等。
(4)2014年南京青奥会火炬使用的燃料为A物质,纯净物A在B物质中充分燃烧,发生反应:A+5B 点燃 3C+4D(部分微观示意图如下所示)。
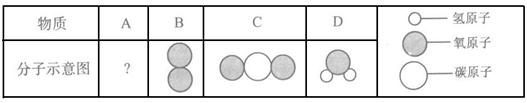
①在上述反应中提供氧,具有氧化性的物质为________;
②A物质中各元素的质量比为________ 。
四、(本题包括2小题,共13分)
19.(5分)U形管中是滴有酚酞溶液的蒸馏水,向左、右两管中同时逐滴滴加一定量的氢氧化钠稀溶液和稀盐酸(如图所示)。
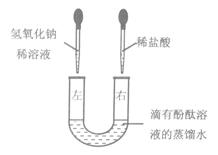
(1)开始时__________管溶液呈红色。
(2)充分反应后U形管中溶液全部呈无色,除酚酞外,此时溶液中一定含有的溶质的名称为_________,可能含有的溶质的化学式为_________ ,写出上述反应的化学方程式_________ 。
20.(8分)下图中的甲、乙、丙表示初中化学常见的物质,且甲、乙、丙为不同类 别的化合物,乙属于氧化物。胃液中含有适量的甲,可帮助消化。图中“—”表示两端的物质问能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物已略去。
别的化合物,乙属于氧化物。胃液中含有适量的甲,可帮助消化。图中“—”表示两端的物质问能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物已略去。

(1)写出甲的化学式 _________ 。
(2)①若乙在常温下为液体,丙可用来改良酸性土壤,则乙的化学式为_________,丙的化学式为_________。
②若乙在常温下为气体,且可由甲与大理石反应得到,则乙的化学式为_________ ,丙能与①中的丙发生复分解反应,其化学方程式为_________(写出一个即可)。
③写出①中的乙和②中的乙发生化合反应的化学方程式为_________ 。
五、(本题包括1小题,共10分)
21.(10分)某兴趣小组对物质的性质和成分进行相关探究。
(1) 常见金属活动性顺序如下,填写相应的元素符号:
常见金属活动性顺序如下,填写相应的元素符号:

金属活动性由强逐渐减弱
某同学用硫酸铜溶液把“铁刀变成铜刀”,其反应的化学方程式为_______,该反应的基本反应类型为_______。
(2)兴趣小组同学用氧化铜与足量的炭粉利用图甲所示的装置进行实验,对生成气体的成分进行探究。
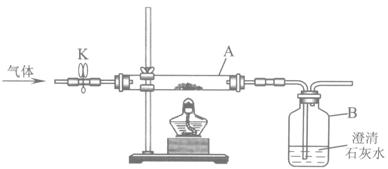
[提出问题]生成的气体中是否含有一氧化碳?
[实验与讨论]
①打开K,缓缓通入干燥的氮气一段时间。
②关闭K,加热至一定温度使之反应,用气囊收集气体样品。
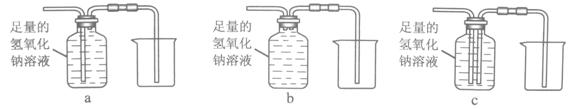
③除去气体样品中的二氧化碳,并将剩余气体收集在集气瓶中,下列装置中最为合理的是_______。
[实验求证]
将除尽二氧化碳后的气体样品干燥,仍然用图甲所示的装置进行实验,A中的固体应选用_______,B中溶液为澄清石灰水,若A中黑色固体出现了红色,B中澄清石灰水_______,可说明气体样品中含有一氧化碳。
[实验反思]
炭粉还原氧化铜的实验中,若生成的气体中含有一氧化碳,则反应时消耗碳、氧元素的质量比_______(填“大于”、“等于”或“小于”)3∶8。
一、选择题(本题共15小题,每小题只有一个选项符合题意。每小题2分,共30分)
1.A 2.A 3.D 4.C 5.C 6.B 7.D 8.B 9.B 10.D
11.D 12.A 13.B 14.C 15.C
说明:
1.主观性试题,答案合理均可给分。
2.书写化学方程式的评分标准:化学式写错不得分,条件、配平、气体或沉淀符号有错漏扣0.5分,不累计扣分。
二、(本题包括2小题,共19分)
16.[本题共8分,化学方程式2分,第(4)小题2分,其余每空1分]
(1)试管 集气瓶
(2)2H2O2=2H2O+O2↑ B
(3)A
(4)氧气不易溶于水,不与水反应
17.[本题共11分,第(3)小题6分,其余每空1分]
(1)蘸有硫酸的部位变黑
(2)浓硫酸 水 玻璃棒 热(或烫)
(3)[解]49g×20%=9.8g
设:最多生成氢气的质量为x。
Zn+H2SO4=ZnSO4+H2↑
98 2
9.8g X
x=0.2g
答:最 多生成氢气的质量是0.2g。
多生成氢气的质量是0.2g。
三、(本题包括1小题,共8分)
18.[本题共8分,第(2)小题、第(4)小题的②每空2分,其余每空1分]
(1)石油
(2)AD
(3)风能 氢能(其他合理答案均可)
(4)①氧气(或O2) ②碳、氢元素的质量比等于9∶2(或氢、碳元素的质量比等于2∶9)
四、(本题包括2小题,共13分)
19.(本题共5分,化学方程式2分,其余每空1分)
(1)左
(2)氯化钠 HCI NaOH+HCl=NaCl+H2O
20.(本题共8分,化学方程式2分,其余每空1分)
(1)HCl
(2)①H2O Ca(OH)2
②CO2 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH(其他合理答案均可)
③CO2+H2O=H2CO3
五、(本题包括1小题,共10分)
21.(本题共10分,化学方程式2分,[实验反思]2分,其余每空 1分)
1分)
(1)Mg Ag Fe+CuSO4=Cu+FeSO4 置换反应
(2)[ 实验与讨论] C
实验与讨论] C
[实验求证] 氧化铜(或CuO) 变浑浊
[实验反思] 大于


